题目内容
已知蓄电池在放电时起原电池的作用,充电时起电解他的作用.铅蓄电池在放电和充电时发生的化学反应可用下式表示:
Pb+PbO2+2H2SO4
2PbSO4+2H2O
据此判断下列叙述中正确的是( )
Pb+PbO2+2H2SO4
| 放电 |
| 充电 |
据此判断下列叙述中正确的是( )
分析:放电时负极反应式为:Pb+SO42--2e-=PbSO4,正极反应式为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,结合电子守恒来解答.
解答:解:A.放电时,负极失去电子,则放电时铅蓄电池负极的电极反应为Pb+SO42--2e-=PbSO4,故A错误;
B.充电时,负极与阴极相连,则阴极的电极反应为PbSO4+2e-=Pb+SO42-,故B正确;
C.用铅蓄电池来电解CuSO4溶液,由电子守恒可知,2H2SO4~2e-~Cu,则生成1.6克Cu,消耗硫酸为
×2=0.05mol,故C正确;
D.由2PbSO4~2e-可知,使3.03千克PbSO4转变为Pb和PbO2,转移电子为
=10mol,故D错误;
故选BC.
B.充电时,负极与阴极相连,则阴极的电极反应为PbSO4+2e-=Pb+SO42-,故B正确;
C.用铅蓄电池来电解CuSO4溶液,由电子守恒可知,2H2SO4~2e-~Cu,则生成1.6克Cu,消耗硫酸为
| 1.6g |
| 64g/mol |
D.由2PbSO4~2e-可知,使3.03千克PbSO4转变为Pb和PbO2,转移电子为
| 3030g |
| 303g/mol |
故选BC.
点评:本题考查铅蓄电池,注意原电池和电解池的分析,明确工作原理及电子守恒是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充电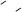 时发生的化学反应可用下式表示:
时发生的化学反应可用下式表示:
据此判断下列叙述中正确的是 ( )
A.放电时正极电极反应式PbO2 + SO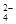 + 2e – + 4 H+= PbSO4 + 2H2O + 2e – + 4 H+= PbSO4 + 2H2O |
| B.充电时蓄电池负极应与电源正极相连接 |
| C.充电时,若要使1mol PbSO4转变为PbO2,则需要通过4mol电子 |
| D.电池放电时,溶液酸性增强 |