题目内容
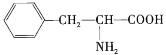
【题目】(1)氯酸钾熔化,粒子间克服了________;(填“离子键”“共价键”或“分子间作用力”,下同);二氧化硅熔化,粒子间克服了______;碘升华,粒子间克服了______。三种晶体的熔点由高到低的顺序是______。
(2)下列六种晶体:①CO2、②NaCl、③Na、④Si、⑤CS2、⑥金刚石,它们的熔点由低到高的顺序为_______(用序号表示)。
(3)A、B、C、D为四种不同类型的晶体,性质如下:A固态时能导电,能溶于盐酸;B能溶于CS2,不溶于水;C固态时不导电,液态时能导电,可溶于水;D固态、液态时均不导电,熔点为3500℃。
试推断它们的晶体类型:A.____________; B.____________; C.____________; D.____________。
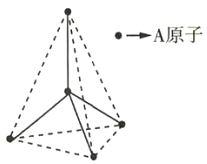
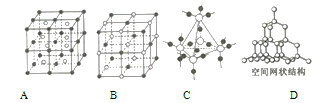
(4)A~D是化学教材中常见的几种晶体结构模型,请填写相应物质的名称:A.____________; B.____________; C.____________; D.____________。
【答案】离子键 共价键 分子间作用力 SiO2>KClO3>I2 ①<⑤<③<②<④<⑥ 金属晶体 分子晶体 离子晶体 原子晶体 氯化铯 氯化钠 二氧化硅 金刚石(或晶体硅)
【解析】
(1)氯酸钾是离子晶体,离子晶体熔化时需要克服离子键;二氧化硅是原子晶体,原子晶体熔化时需要克服共价键;碘为分子晶体,碘升华时需克服的是分子间作用力。由于原子晶体是由共价键形成的具有空间网状结构的晶体,所以原子晶体的熔点最高;其次是离子晶体;由于分子间作用力与化学键相比要弱得多,所以碘的熔点最低,故答案为:离子键;共价键;分子间作用力;SiO2>KClO3>I2;
(2)可将六种晶体分类,原子晶体:④⑥;离子晶体:②;金属晶体:③;分子晶体:①⑤。由于C原子半径小于Si原子半径,所以金刚石的熔点高于晶体硅;CO2和CS2同属于分子晶体,二者组成与结构相似,熔点高低取决于相对分子质量大小,故CS2的熔点高于CO2的熔点;Na在通常状况下是固态,而CS2是液态,CO2是气态,所以Na的熔点高于CS2和CO2,故答案为:①<⑤<③<②<④<⑥;
(3)A固态时能导电,能溶于盐酸,属于金属晶体;B能溶于CS2,不溶于水,属于分子晶体;C固态时不导电,液态时能导电,可溶于水,属于离子晶体;D固态液态时均不导电,熔点为3500℃,属于原子晶体,故答案为:金属晶体;分子晶体;离子晶体;原子晶体;
(4)由晶胞结构糢型可知A、B、C、D分别为氯化铯、氯化钠、二氧化硅、金刚石(或晶体硅)的晶体结构模型,故答案为:氯化铯;氯化钠;二氧化硅;金刚石(或晶体硅)。