题目内容
【题目】利用太阳能电解水制H2是解决能源危机的重要方向。采用固体氧化还原调节剂作为离子交换体系,实现H2、O2分离。下列分析正确的是( )
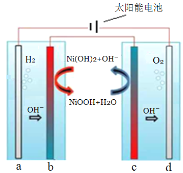
A.左侧电解池应选用酸性溶液,a极反应式为:2H+ + 2e-=H2↑
B.b极反应式:NiOOH + H2O + e-=Ni(OH)2 + OH-
C.c为阳极,发生氧化反应
D.电解一段时间后,可将b、c对调,循环利用物质
【答案】D
【解析】
A.根据图示,左侧电解池应选用碱性溶液,连接电源负极的为阴极,则a为阴极,阴极发生还原反应,电极反应式为2H2O+2e- = H2↑+ 2OH―,故A错误;
B.连接电源负极的为阴极,则a为阴极,b为阳极,阳极失电子发生氧化反应,故电极反应方程式为Ni(OH)2+OH--e-=NiOOH+H2O,故B错误;
C.连接电源正极的为阳极,则d为阳极,c为阴极,阴极发生还原反应,故C错误;
D.b电极发生的反应Ni(OH)2+OH--e-=NiOOH+H2O,c电极发生的反应为NiOOH+H2O+e-=Ni(OH)2+OH-,故电解一段时间后,可将b、c对调,循环利用,故D正确;
故选D。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目