题目内容
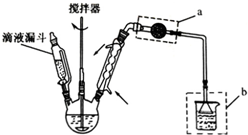
9.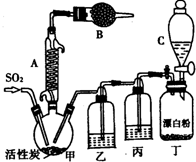 氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的反应和实验装置如下:
氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的反应和实验装置如下:SO2(g)+Cl2(g)$\frac{\underline{\;催化剂\;}}{\;}$SO2Cl2(l)△H=-97.3kJ/mol.
有关信息如下:硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解.回答下列问题:
(1)装置甲中仪器A的名称为冷凝管,甲中活性炭的作用是催化剂,B的作用为防止水蒸气进入;
(2)装置丁中发生反应的离子方程式为Cl-+ClO-+2H+=Cl2↑+H2O;
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4,分离产物的方法是C(填字母).;
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)装置丙的作用为除去HCl气体,若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4;
(5)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有①②③(填序号).
①先通冷凝水,再通气
②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温
④加热三颈烧瓶.
分析 (1)根据仪器的构造可判断装置甲中仪器A的名称;该反应需要催化剂,则甲中活性炭的作用是催化剂;硫酰氯在潮湿空气中“发烟”,而空气中含有水蒸气;
(2)装置丁是提供氯气的,在酸性溶液中漂白粉能氧化氯离子生成氯气;
(3)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯与另外一种物质,根据原子守恒可知另一种生成物是硫酸;硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,而硫酸沸点高;
(4)生成的氯气中含有氯化氢;氯气和二氧化硫可能发生反应生成硫酸;
(5)由于硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解.
解答 解:(1)根据仪器的构造可判断装置甲中仪器A的名称为冷凝管或蛇形冷凝管或环形冷凝管;该反应需要催化剂,则甲中活性炭的作用是催化剂;硫酰氯在潮湿空气中“发烟”,而空气中含有水蒸气,则B的作用为防止水蒸气进入,故答案为:冷凝管或蛇形冷凝管或环形冷凝管;催化剂;防止水蒸气进入;
(2)装置丁是提供氯气的,在酸性溶液中漂白粉能氧化氯离子生成氯气,则装置丁中发生反应的离子方程式为Cl-+ClO-+2H+=Cl2↑+H2O,故答案为:Cl-+ClO-+2H+=Cl2↑+H2O;
(3)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯与另外一种物质,根据原子守恒可知另一种生成物是硫酸,因此该反应的化学方程式为2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4;硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,而硫酸沸点高,则分离产物的方法是蒸馏,答案选C,故答案为:2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4;C;
(4)生成的氯气中含有氯化氢,所以装置丙的作用为除去HCl气体.氯气具有强氧化性,能氧化SO2,装置乙是干燥氯气的,因此若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4,故答案为:除去HCl气体;Cl2+SO2+2H2O=2HCl+H2SO4;
(5)由于硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解,因此为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有①先通冷凝水,再通气,②控制气流速率,宜慢不宜快,③若三颈烧瓶发烫,可适当降温,但不能加热三颈烧瓶,否则会加速分解,答案选①②③.故答案为:①②③.
点评 本题考查实验制备方案,涉及对反应原理、装置及操作的分析评价、对仪器的识别、物质的分离提纯等,注意对物质性质信息的应用,难度中等.

| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)减小,c(H+)减小 | |
| B. | 将水加热,KW增大,pH变小 | |
| C. | 向水中加入少量HCl气体,平衡逆向移动,c(H+)减小,c(OH-)减小 | |
| D. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
| A. | Al2O3硬度高,熔点2054℃,沸点2980℃,属于原子晶体 | |
| B. | 在晶体中,只要有阴离子一定有阳离子 | |
| C. | 某固态单质能导电,该单质一定属于金属晶体 | |
| D. | SiO2分子中每个Si原子周围有4个O原子,每个O原子周围有2个Si原子 |
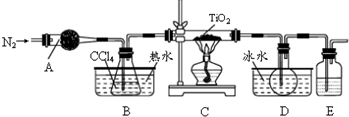
①反应原理:TiO2(s)+CCl4(g) $\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g)
②反应条件:无水无氧且加热
③实验装置如图所示:
④有关物质的性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是球形干燥管,其中装的试剂不可能是a(填序号)
a.无水硫酸铜 b.碱石灰 c.氯化钙 d.烧碱
(2)实验整个过程中通入N2的目的是排除装置中的空气,保证反应在无水无氧环境下进行
(3)装置E中的试剂是浓硫酸(写名称),其作用是防止空气中水蒸气、氧气进入.E装置不能(填“能”或“不能”)被A装置代替,原因是A装置不能吸收空气中的氧气,不能保证反应在无氧环境下进.
(4)实验开始前的操作包括有:组装仪器、检查装置的气密性、加装药品、通一会儿氮气、最后点燃酒精灯.
(5)制备结束后的操作有:①停止通N2 ②熄灭酒精灯 ③冷却至室温.正确的操作顺序为c(填序号)a.①②③b.③②①c.②③①d.②①③
(6)欲分离D装置中的TiCl4,所采用的实验操作为蒸馏(填操作名称),该实验不可能用到的仪器有d(填序号)a.蒸馏烧瓶 b.接收器 c.直形冷凝管 d.球形冷凝管
温度应控制在76℃,温度计的水银球应插在蒸馏烧瓶的支管口附近,最后得到TiCl4 9.5g.
(7)本实验所得到的TiCl4的产率是b(填序号)
a.40% b.50% c.60% d.70%
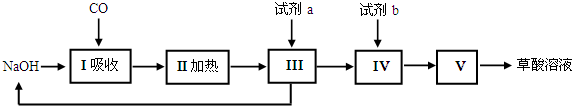
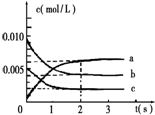 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.