题目内容
已知下列热化学方程式:
C(s)+O2(g)=CO2(g);ΔH=-393.5kJ/mol
2H2(g)+O2(g)=2H2O(g);ΔH=-483.6kJ/mol
现有0.2mol的炭粉和氢气组成的悬浊气、固混合物在氧气中完全燃烧,共放出63.53kJ的热量,则炭粉与氢气的物质的量之比为
[ ]
A.1∶1
B.1∶2
C.2∶3
D.3∶2
答案:A
解析:
解析:
|
导解:设炭粉的物质的量为x,则氢气的物质的量为(0.2mol-x),列式得: x·393.5kJ/mol+(0.2mol-x)/2×483.6kJ/mol=63.53kJ 求出x,即可得比. |

练习册系列答案
相关题目
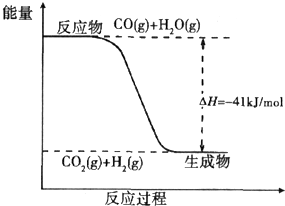 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.