题目内容
已知热化学方程式N2(g) + 3H2(g) 2NH3(g) + Q kJ(Q>0),下列说法中,正确的是
2NH3(g) + Q kJ(Q>0),下列说法中,正确的是
 2NH3(g) + Q kJ(Q>0),下列说法中,正确的是
2NH3(g) + Q kJ(Q>0),下列说法中,正确的是| A.1mol N2(g)和3mol H2(g)具有的能量之和低于2 mol NH3(g)具有的能量 |
| B.将1mol N2 (g)和3mol H2 (g)置于一密闭容器中充分反应后放出Q kJ的热量 |
| C.升高温度,平衡向逆反应方向移动,上述热化学方程式中的Q值减小 |
| D.将一定量N2(g)和H2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有3mol H2被氧化 |
D
试题分析:A、正方应是放热反应,则1mol N2(g)和3mol H2(g)具有的能量之和高于2 mol NH3(g)具有的能量,A不正确;B、反应是可逆反应,则将1mol N2 (g)和3mol H2 (g)置于一密闭容器中充分反应后放出的热量小于Q kJ,B不正确;C、反应热与平衡移动无关系,C不正确;D、根据热化学方程式可知每消耗3mol氢气放出QkJ热量,因此将一定量N2(g)和H2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有3mol H2被氧化,D正确,答案选D。

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
 N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出 kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出 kJ能量。
 2Cl2+2H2O,
2Cl2+2H2O, 
 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1
2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1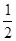 O2(g)
O2(g) O2(g)=CO2(g)ΔH2=-283 kJ/mol
O2(g)=CO2(g)ΔH2=-283 kJ/mol 2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。
2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。