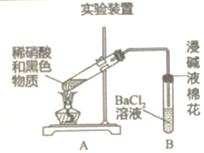
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΡ≥Ά§―ß‘Ύ Β―ι “ΉωΆ≠”κ≈®ΝρΥαΖ¥”ΠΒΡ Β―ιΓΘ
Θ®1Θ©–¥≥ωΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ_____ΓΘ
ΆΘ÷ΙΦ”»»Θ§ΫΪ ‘Ιή÷–ΒΡΜλΚœΈοά以ΚσΒΙ»κΉΑ”–άδΥ°ΒΡ…’±≠÷–Θ§ΫΝΑηΓΔΨ≤÷ΟΘ§Ιέ≤λΒΫ…’±≠ΒΉ≤Ω”–ΚΎ…ΪΈο÷ ΓΘ”Ύ «ΥϊΕ‘ΚΎ…ΪΈο÷ Ϋχ––ΝΥΧΫΨΩΓΘ
Θ®2Θ©ΗΟΆ§―ßΦΌ…ηΚΎ…ΪΈο÷ CuOΓΘΦλ―ιΙΐ≥Χ»γœ¬ΘΚ
Θ®≤ι‘ΡΈΡœΉΘΚΦλ―ιΈΔΝΩCu2ΘΪΒΡΖΫΖ® «ΘΚœρ ‘“Κ÷–ΒΈΦ”K4[Fe(CN)6]»ή“ΚΘ§»τ≤ζ…ζΚλΚ÷…Ϊ≥ΝΒμΘ§÷ΛΟς”–Cu2ΘΪΘ©ΗΟΆ§―ßΒΡ Β―ι≤ΌΉςΘΚ
ΔΌΫΪCuOΖ≈»κœΓΝρΥα÷–Θ§“ΜΕΈ ±ΦδΚσΘ§ΒΈΦ”K4[Fe(CN)6]»ή“ΚΘ§≤ζ…ζΚλΚ÷…Ϊ≥ΝΒμΓΘ
ΔΎΫΪΚΎ…ΪΈο÷ Ζ≈»κœΓΝρΥα÷–Θ§“ΜΕΈ ±ΦδΚσΘ§ΒΈΦ”K4[Fe(CN)6]»ή“ΚΘ§Έ¥ΦϊΚλΚ÷…Ϊ≥ΝΒμΓΘ Β―ιΔΌΒΡΡΩΒΡ «__________Θ§”…ΗΟΦλ―ιΙΐ≥ΧΥυΒΟΫα¬έ «________ΓΘ
Θ®3Θ©‘Ό¥ΈΦΌ…ηΘ§ΚΎ…ΪΈο÷ «Ά≠ΒΡΝρΜ·ΈοΓΘ Β―ι»γœ¬ΘΚ
Β―ιΉΑ÷Ο
| œ÷œσ 1.A ‘Ιή÷–ΚΎ…Ϊ≥ΝΒμ÷πΫΞ»ήΫβ 2.A ‘ΙήΡΎ…œΖΫ≥ωœ÷«≥ΚλΉΊ…ΪΤχΧε 3.B ‘Ιή÷–≥ωœ÷Γ≠Γ≠ |
ΔΌœ÷œσ2ΥΒΟςΚΎ…ΪΈο÷ ΨΏ”–________–‘ΓΘ
ΔΎ A ‘ΙήΡΎ…œΖΫ≥ωœ÷«≥ΚλΉΊ…ΪΤχΧεΒΡΜ·―ßΖΫ≥Χ Ϋ «__________ΓΘ
ΔέΡή»Ζ»œΚΎ…Ϊ≥ΝΒμ÷–Κ§”–S‘ΣΥΊΒΡœ÷œσ_________ΓΘ
Θ®4Θ©“‘…œ Β―ιΥΒΟςΘ§ΚΎ…ΪΈο÷ ÷–¥φ‘ΎΆ≠ΒΡΝρΜ·ΈοΓΘΫχ“Μ≤Ϋ Β―ιΚσ÷ΛΟςΚΎ…ΪΈο÷ « CuS”κCu2SΒΡΜλΚœΈοΓΘ“―÷Σ1molCu2S”κœΓœθΥαΖ¥”ΠΉΣ“Τ8mole-Θ§–¥≥ω ‘ΙήA÷–Cu2S »ήΫβΒΡΜ·―ßΖΫ≥Χ Ϋ____________ΓΘ
ΓΨ¥πΑΗΓΩ2H2SO4(≈®)+Cu![]() CuSO4+SO2Γϋ+2H2O ΉωΕ‘±» Β―ι ΚΎ…Ϊ≥ΝΒμ÷–≤ΜΚ§CuO ΜΙ‘≠–‘ 2NO+O2=2NO2 B ‘Ιή÷–≥ωœ÷ΑΉ…Ϊ≥ΝΒμ 3Cu2S+20HNO3
CuSO4+SO2Γϋ+2H2O ΉωΕ‘±» Β―ι ΚΎ…Ϊ≥ΝΒμ÷–≤ΜΚ§CuO ΜΙ‘≠–‘ 2NO+O2=2NO2 B ‘Ιή÷–≥ωœ÷ΑΉ…Ϊ≥ΝΒμ 3Cu2S+20HNO3![]() 6Cu(NO3)2+3SO2Γϋ+8NOΓϋ+10H2O
6Cu(NO3)2+3SO2Γϋ+8NOΓϋ+10H2O
ΓΨΫβΈωΓΩ
Θ®1Θ©άϊ”Ο≈®ΝρΥαΒΡ«Ω―θΜ·–‘Θ§Ά≠ΚΆ≈®ΝρΥαΖ¥”ΠΒΡΖΫ≥Χ ΫΈΣCuΘΪ2H2SO4(≈®) ![]() CuSO4ΘΪSO2ΓϋΘΪ2H2OΘΜ
CuSO4ΘΪSO2ΓϋΘΪ2H2OΘΜ
Θ®2Θ©ΔΌΫΪCuOΖ≈»κœΓΝρΥα÷–Θ§ΖΔ…ζCuOΘΪH2SO4=CuSO4ΘΪH2OΘ§ΗυΨί–≈œΔΘ§œρΖ¥”ΠΚσ»ή“Κ÷–ΒΈΦ”K4[Fe(CN)6]»ή“ΚΘ§»ή“Κ÷–≥ωœ÷ΚλΚ÷…Ϊ≥ΝΒμΘΜ
ΔΎΫΪΚΎ…ΪΈο÷ Ζ≈»κœΓΝρΥα÷–Θ§“ΜΕΈ ±ΦδΚσΘ§ΒΈΦ”K4[Fe(CN)6]»ή“ΚΘ§Έ¥ΦϊΚλΚ÷…Ϊ≥ΝΒμΘ§ΥΒΟς»ή“Κ÷–≤ΜΚ§Cu2ΘΪΘ§Φ¥ΚΎ…ΪΈο÷ ÷–≤ΜΚ§CuOΘΜ Β―ιΔΌΒΡΡΩΒΡ «ΉωΕ‘±» Β―ιΙέ≤λΖ¥”Πœ÷œσΘΜ
Θ®3Θ©ΔΌΚΎ…ΪΈο÷ ”κœΓœθΥαΖ¥”ΠΘ§ΚΎ…Ϊ≥ΝΒμ÷πΫΞ»ήΫβΘ§A ‘ΙήΡΎ…œΖΫ≥ωœ÷«≥ΚλΉΊ…ΪΤχΧεΘ§ΗΟΤχΧεΈΣNO2Θ§ΥΒΟςΚΎ…ΪΈο÷ ”κœΓœθΥαΖ¥”Π≤ζ…ζNOΘ§÷ΛΟςΝΥΚΎ…ΪΙΧΧεΨΏ”–ΜΙ‘≠–‘ΘΜ
ΔΎΗυΨίΔΌΒΡΖ÷ΈωΘ§ΤδΖ¥”ΠΖΫ≥Χ ΫΈΣ2NOΘΪO2=2NO2ΘΜ
Δέ÷ΛΟςS‘ΣΥΊΒΡ¥φ‘ΎΘ§ ‘ΙήA÷–S‘ΣΥΊ±Μ―θΜ·≥…SO2Θ§NO2ΚΆSO2Ϋχ»κBaCl2»ή“Κ÷–ΖΔ…ζNO2ΘΪSO2ΘΪBa2ΘΪΘΪH2O=BaSO4ΓΐΘΪNOΓϋΘΪ2HΘΪΘ§Φ¥Β±B ‘Ιή÷–”–ΑΉ…Ϊ≥ΝΒμ≤ζ…ζΘ§ΥΒΟςΚΎ…Ϊ≥ΝΒμ÷–Κ§”–S‘ΣΥΊΘΜ
Θ®4Θ©1molCu2S”κœΓœθΥαΖ¥”ΠΉΣ“Τ8moleΘ≠Θ§ΥΒΟςS‘ΣΥΊ±Μ―θΜ·≥…SO2Θ§Φ¥Ζ¥”ΠΜ·―ßΖΫ≥Χ ΫΈΣ3Cu2SΘΪ20HNO3![]() 6Cu(NO3)2ΘΪ3SO2ΓϋΘΪ8NOΓϋΘΪ10H2OΓΘ
6Cu(NO3)2ΘΪ3SO2ΓϋΘΪ8NOΓϋΘΪ10H2OΓΘ

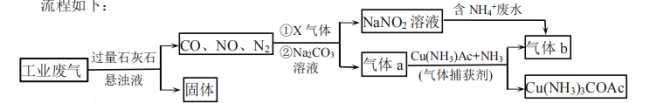
ΓΨΧβΡΩΓΩX»ή“Κ÷–Κ§”–œ¬±μΥυ ΨάκΉ”÷–ΒΡΡ≥5÷÷Θ§«“ΤδάκΉ”≈®Ε»ΨυΈΣ![]() (≤ΜΩΦ¬«Υ°ΒΡΒγάκΚΆάκΉ”Υ°Ϋβ)ΓΘœρX»ή“Κ÷–Φ”»κΉψΝΩœΓ―ΈΥαΘ§”–ΤχΧε…ζ≥…Θ§Ζ¥”Π«ΑΚσ“θάκΉ”÷÷άύ≤Μ±δΓΘœ¬Ν––π ω¥μΈσΒΡ «( )
(≤ΜΩΦ¬«Υ°ΒΡΒγάκΚΆάκΉ”Υ°Ϋβ)ΓΘœρX»ή“Κ÷–Φ”»κΉψΝΩœΓ―ΈΥαΘ§”–ΤχΧε…ζ≥…Θ§Ζ¥”Π«ΑΚσ“θάκΉ”÷÷άύ≤Μ±δΓΘœ¬Ν––π ω¥μΈσΒΡ «( )
―τάκΉ” |
|
“θάκΉ” |
|
A.‘≠»ή“Κ÷–“ΜΕ®Κ§”–![]()
B.X»ή“Κ÷–≤ΜΩ…ΡήΚ§”–![]() ΚΆ
ΚΆ![]()
C.X»ή“Κ÷–Κ§”–3÷÷―τάκΉ”ΓΔ2÷÷“θάκΉ”
D.…ζ≥…ΤχΧεΒΡάκΉ”Ζ¥”ΠΖΫ≥Χ ΫΈΣ![]()