题目内容
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
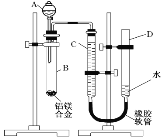
I.(配制酸性KMnO4标准溶液)如图是配制50 mL酸性KMnO4标准溶液的过程示意图。

(1)请你观察图示判断其中不正确的操作有____(填序号)。
(2)其中确定50 mL溶液体积的容器是____(填名称)。
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测的实验结果将_______(填“偏大”或“偏小”)。
II.(测定血液样品中Ca2+的浓度)抽取血样20. 00 mL,经过上述处理后得到草酸,再用0.020 mol/L酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL酸性KMnO4溶液。
(4)已知草酸与酸性KMn04溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mnx++10CO2↑+8H2O,则式中的x=____。
(5)滴定时,根据现象____,即可确定反应达到终点。
(6)经过计算,血液样品中Ca2+的浓度为____mg.cm-3。
【答案】②⑤ 50mL容量瓶 偏小 2 溶液由无色变为紫红色,且半分钟内不褪色 1.2
【解析】
(1)根据配制一定物质的量浓度的溶液的正确操作结合图示分析;
(2)容量瓶是确定溶液体积的仪器;
(3)仰视刻度线,会使溶液体积偏大,结合C=n/V分析;
(4)草酸跟酸性KMnO4溶液反应生成二氧化碳、二价锰离子等,结合氧化还原反应得失电子守恒和根据电荷守恒进行分析,写出化学方程式得到x;
(5)滴定时,用高锰酸钾滴定草酸,反应达到终点时,滴入的高锰酸钾溶液不褪色,据此判断;
(6)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度.
(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至溶液凹液面与刻度线相切;
(2)应该用容量瓶准确确定50mL溶液的体积;
(3)用图示的操作配制溶液,仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小;
(4)根据电荷守恒,(-1×2)+(+1×6)=+x×2,解得,x=2,草酸跟KMnO4反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O;
(5)滴定时,用高锰酸钾滴定草酸,反应达到终点时的现象为溶液由无色变为紫红色,且半分钟内不褪色;
(6)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol·L-1×0.012L=2.4×10-4mol,根据反应方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=5/2n(MnO4-)=2.5×2.4×10-4mol=6×10-4mol,Ca2+的质量为:40g·mol-1×6×10-4mol=0.024g,钙离子的浓度为:0.024g/20cm 3=1.2 mg·cm-3。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案