题目内容
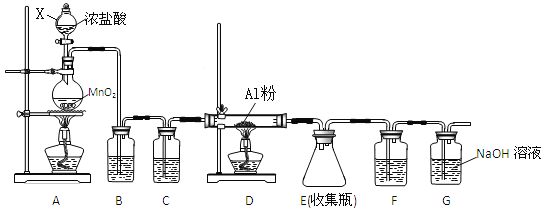
【题目】I.某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
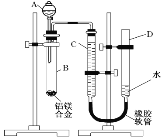
(1)实验前,先将铝镁合金在稀酸中浸泡片刻。检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;②待B中不再有气体产生并恢复至室温后,记录C的液面位置;③检查气密性;④由A向B中滴加足量试剂;⑤将B中剩余固体过滤,洗涤,干燥,称重,上述操作的顺序是_______,(填序号)②中记录C的液面位置前,还应______。
(2)A中装的试剂为________。
(3)若实验用铝镁合金的质量为m1g,测得氢气体积为amL(已换算为标准状况),B中剩余固体的质量为m2g,则铝的相对原子质量为_______。
II.某化学研究小组的同学,为了探究催化剂对化学反应速率的影响,做了以下实验:将0.20mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示
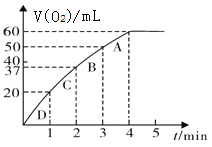
(4)A、B、C、D各点反应速率快慢的顺序为_______。
(5)计算H2O2的初始物质的量浓度_____ (请保留两位有效数字) 。
【答案】③①④②⑤ 使D和C的液面相平 NaOH溶液 33600(m1 -m2)/a D>C>B>A 0.11mol·L-1
【解析】
(1)整个操作过程及原理是:检查气密性;记录起始液面;加入碱反应;不产生气体后,记录未读数,两将相减即为产生H2的量;最后称得的固体即为Mg的质量,则操作的顺序为:③①④②⑤,在读数时要注意D、C液面相平,否则气体将受压,超成读数不准。
(2)Mg、Al均可以和酸反应,因此不可以用酸来实验,由于Al可以和碱反应而不和Mg反应,则可以用NaOH与Al反应制得H2,然后用排水法收集H2,以计算Al的量,所以A试剂为NaOH;
(3)实验反应了金属Al(m1-m2)g,生成n(H2)= ![]() ,则n(Al)=
,则n(Al)= ![]() ×
×![]() =
=![]() mol,M(Al)=
mol,M(Al)= ![]() =
=![]() =;
=;
(4)由图像可知,相同时间内,生成O2的体积变化可知,D点产出O2最多,反应速率最快,其次是C点,B点,A点产生氧气最少,反应速率最慢,则A、B、C、D各点反应速率快慢的顺序为D>C>B>A;
(5)从图像可知,反应结束生成标况下氧气60mL,则n(O2)= ![]() =0.0027mol,n(H2O2)=2 n(O2)=2×
=0.0027mol,n(H2O2)=2 n(O2)=2×![]() =0.0053mol,c(H2O2)=
=0.0053mol,c(H2O2)= ![]() =0.11mol/L;
=0.11mol/L;

【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D