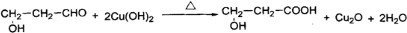题目内容
(2011?自贡模拟)阿伏加德罗常数用NA表示,下列叙述正确的是( )
①常温常压下,2.24L D2气体分子含有的中子数为小于0.2NA
②含有0.32克氧元素的二氧化硅中含有的硅氧键数目为0.02NA
③0.44gC3H8中含有的极性共价键总数目为0.1NA
④7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA
⑤46g二氧化氮与四氧化二氮的混合气体的平均分子量46<M<92
⑥11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑦1mol冰醋酸和1mol乙醇在加热和浓硫酸的条件下充分反应生成的水分子数为NA.
①常温常压下,2.24L D2气体分子含有的中子数为小于0.2NA
②含有0.32克氧元素的二氧化硅中含有的硅氧键数目为0.02NA
③0.44gC3H8中含有的极性共价键总数目为0.1NA
④7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA
⑤46g二氧化氮与四氧化二氮的混合气体的平均分子量46<M<92
⑥11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑦1mol冰醋酸和1mol乙醇在加热和浓硫酸的条件下充分反应生成的水分子数为NA.
分析:①依据气体摩尔体积的条件应用分析判断;
②质量换算物质的量结合二氧化硅的结构分析判断;
③质量换算物质的量结合分子结构和极性共价键的概念进行计算;
④质量换算物质的量,结合过氧化钠氧化二氧化硫的氧化还原反应的电子转移分析判断;
⑤依据平均摩尔质量的概念结合两种气体的摩尔质量进行分析判断;
⑥依据气体摩尔体积的条件应用分析判断;
⑦依据酯化反应在浓硫酸催化作用下发生的反应是化学平衡状态,不可能进行完全.
②质量换算物质的量结合二氧化硅的结构分析判断;
③质量换算物质的量结合分子结构和极性共价键的概念进行计算;
④质量换算物质的量,结合过氧化钠氧化二氧化硫的氧化还原反应的电子转移分析判断;
⑤依据平均摩尔质量的概念结合两种气体的摩尔质量进行分析判断;
⑥依据气体摩尔体积的条件应用分析判断;
⑦依据酯化反应在浓硫酸催化作用下发生的反应是化学平衡状态,不可能进行完全.
解答:解:①标准状况下2.24LD2气体物质的量为0.1mol,但常温常压下2.24LD2气体物质的量小于0.1mol,所以分子最中含有的中子数为小于0.2NA,故①正确;
②0.32克氧元素物质的量为0.02mol,1mol二氧化硅含有2mol氧原子,所以含0.02mol氧原子的二氧化硅为0.01mol,含有的硅氧键数目为0.04NA,故②错误;
③0.44gC3H8物质的量为0.01mol,通式判断物质为烷烃,0.01mol丙烷含有的极性共价键是碳原子与氢原子形成的化学键为0.08mol,故③错误;
④7.8g过氧化钠粉末物质的量为0.1mol,发生的反应为Na2O2+SO2=Na2SO4,0.1mol过氧化钠反应转移的电子物质的量为0.2mol,即电子数为0.2NA,故④正确;
⑤46g二氧化氮与四氧化二氮的混合气体的平均分子量一定介于46-92之间,混合气体的平均分子量46<M<92,故⑤正确;
⑥温度和压强未知,11.2LCl2的物质的量不是0.5mol,故⑥错误;
⑦1mol冰醋酸和1mol乙醇在加热和浓硫酸的条件下发生的反应是活性平衡,不可能进行彻底,所以生成的水分子数小于NA.故⑦错误;
综上所述①④⑤正确;
故选D.
②0.32克氧元素物质的量为0.02mol,1mol二氧化硅含有2mol氧原子,所以含0.02mol氧原子的二氧化硅为0.01mol,含有的硅氧键数目为0.04NA,故②错误;
③0.44gC3H8物质的量为0.01mol,通式判断物质为烷烃,0.01mol丙烷含有的极性共价键是碳原子与氢原子形成的化学键为0.08mol,故③错误;
④7.8g过氧化钠粉末物质的量为0.1mol,发生的反应为Na2O2+SO2=Na2SO4,0.1mol过氧化钠反应转移的电子物质的量为0.2mol,即电子数为0.2NA,故④正确;
⑤46g二氧化氮与四氧化二氮的混合气体的平均分子量一定介于46-92之间,混合气体的平均分子量46<M<92,故⑤正确;
⑥温度和压强未知,11.2LCl2的物质的量不是0.5mol,故⑥错误;
⑦1mol冰醋酸和1mol乙醇在加热和浓硫酸的条件下发生的反应是活性平衡,不可能进行彻底,所以生成的水分子数小于NA.故⑦错误;
综上所述①④⑤正确;
故选D.
点评:本题考查了阿伏伽德罗常数的条件应用,主要考查气体摩尔体积的条件应用,质量换算物质的量,结合二氧化硅和烷烃的结构来计算共价键数、氧化还原反应的电子转移的计算,酯化反应的可逆性判断.

练习册系列答案
相关题目