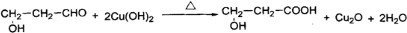题目内容
(2011?自贡模拟)下列热化学方程式或离子方程式中,正确的是( )
分析:A、原电池负极发生氧化反应,甲烷在负极放电,在碱性条件下生成碳酸根离子与水;
B、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,参加反应的氮气物质的量小于0.51mol;
C、燃烧热指在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.单位为kJ/mol,生成的水应为液态;
D、向苯酚钠(C6H5ONa)溶液中通入少量二氧化碳生成苯酚与碳酸氢钠.
B、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,参加反应的氮气物质的量小于0.51mol;
C、燃烧热指在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.单位为kJ/mol,生成的水应为液态;
D、向苯酚钠(C6H5ONa)溶液中通入少量二氧化碳生成苯酚与碳酸氢钠.
解答:解:A、原电池负极发生氧化反应,甲烷在负极放电,在碱性条件下生成碳酸根离子与水,电极反应式为CH4-8e-+10OH-=CO32-+7H2O,故A正确;
B、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,反应为可逆反应,参加反应的氮气物质的物质的量小于1mol,所以1mol氮气反应,放出的热量大于38.6kJ,故B错误;
C、乙烯的燃烧热为akJ/mol(a>0),表示1mol乙烯应为完全燃烧生成二氧化碳与液态水放出热量为akJ,乙烯燃烧热的热化学方程式为C2H4(g)+3O2(g)=2CO2(g)+2H2O(l);△H=-akJ/mol,故C错误;
D、向苯酚钠(C6H5ONa)溶液中通入少量二氧化碳生成苯酚与碳酸氢钠,离子方程式为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故D错误.
故选A.
B、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,反应为可逆反应,参加反应的氮气物质的物质的量小于1mol,所以1mol氮气反应,放出的热量大于38.6kJ,故B错误;
C、乙烯的燃烧热为akJ/mol(a>0),表示1mol乙烯应为完全燃烧生成二氧化碳与液态水放出热量为akJ,乙烯燃烧热的热化学方程式为C2H4(g)+3O2(g)=2CO2(g)+2H2O(l);△H=-akJ/mol,故C错误;
D、向苯酚钠(C6H5ONa)溶液中通入少量二氧化碳生成苯酚与碳酸氢钠,离子方程式为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故D错误.
故选A.
点评:本题考查反应热、离子方程式、电极反应式等,难度较大,注意A中电极反应式书写,可以利用总反应式减去正极反应式解答.

练习册系列答案
相关题目