题目内容
17. 如图为元素周期表截取的短周期的一部分,四种元素均不是稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表截取的短周期的一部分,四种元素均不是稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | z的最高正化合价与最低负化合价的绝对值可能相等 | |
| D. | w的最高价氧化物的水化物可能为弱酸,也有可能为强酸 |
分析 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素,由于ⅡA、ⅢA族在周期表中之间相隔10列,故Z至少处于ⅢA族,Y最多处于ⅦA,且X、Y处于第二周期,Z、W处于第三周期.
A.同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
B.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
C.W处于第三周期,可能处于ⅣA族或ⅤA或ⅥA族,最高正价=族序数,最低负化合价=族序数-8;
D.W可能为Si、P、S.
解答 解:如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素,由于ⅡA、ⅢA族在周期表中之间相隔10列,故Z至少处于ⅢA族,Y最多处于ⅦA,且X、Y处于第二周期,Z、W处于第三周期;
A.同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,则原子半径:Z>W>X>Y,故A错误;
B.同周期元素从左到右非金属性逐渐增强,同主族元素从上到下元素的非金属性逐渐减弱,且元素的非金属性越强,对应氢化物的稳定性越大,则气态氢化物的稳定性:Y>X>W>Z,故B错误;
C.如W为Si,则四种元素分别为C、N、Al、Si,W的最高正化合价与负化合价的绝对值相等,故C正确;
D.W可能为Si、P、S,硅酸、磷酸属于弱酸,而硫酸属于强酸,W的最高价氧化物的水化物可能为弱酸,也有可能为强酸,故D正确,
故选:CD.
点评 本题考查元素周期表与元素周期律综合应用,注意ⅡA、ⅢA族在周期表中之间相隔10列,二者在周期表中不相邻,学生容易忽略,为易错题目.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
7.室温下,1mol无水硫酸铜(CuSO4)溶于水放出a kJ的热,胆矾(CuSO4•5H2O)受热失水的热化学方程式为CuSO4•5H2O(s)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4(s)+5H2O(s)△H=+b kJ/mol,又知胆矾溶于水会使溶液温度降低,则a、b的关系为( )
| A. | a<b | B. | a>b | C. | a=b | D. | 无法确定 |
8.化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | 焰火中呈现的绚丽色彩,是各种金属元素焰色反应形成的 | |
| B. | 我国是最早使用青铜合金的国家之一,目前世界上使用量最大的合金是钢 | |
| C. | 雾霾的形成与工业排放的烟气、汽车尾气、秸秆焚烧等没有关系 | |
| D. | 推广使用燃煤脱硫技术,可防治SO2污染 |
5.在一定条件下,Ti和I2可以发生如下反应:Ti(s)+2I2(g)$→_{1300~1500℃}^{100~200℃}$ TiI4(g),下列说法正确的是( )
| A. | 该反应△S>0 | |
| B. | 利用该反应可以除去Ti中的Si | |
| C. | 在100℃时,不可能有Ti存在 | |
| D. | 增加Ti固体的量有利于平衡向右移动 |
12.“北大富硒康”中含有微量元素硒(Se),对人体有保健作用.已知硒为第四周期第ⅥA族元素,根据它在周期表中的位置推测,硒不可能具有的性质为( )
| A. | 硒化氢很稳定 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 非金属性比硫弱 | |
| D. | 其最高价氧化物的水化物酸性强于砷弱于溴 |
2.下列各项化学用语中表达正确的是( )
| A. | 氯原子的结构示意图: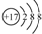 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 氢氧根离子的电子式: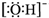 | |
| D. | 中子数为146、质子数为92 的铀(U)原子:${\;}_{92}^{146}$U |
9.关于如图所示的原电池,下列说法正确的是( )
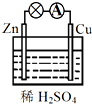

| A. | Cu为正极,SO42+向正极移动 | B. | 电子由铜片通过导线流向锌片 | ||
| C. | 该装置能将电能转化为化学能 | D. | 正极反应为 2H++2e-═H2↑ |
6.L-多巴可用于治疗帕金森综合症,其结构简式为: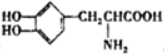 ,下列关于它的叙述正确的是( )
,下列关于它的叙述正确的是( )
 ,下列关于它的叙述正确的是( )
,下列关于它的叙述正确的是( )| A. | L-多巴只含有2中官能团 | |
| B. | L-多巴不能发生肽反应 | |
| C. | L-多巴既具有酸性,又具有碱性 | |
| D. | 1molL-多巴只能与含1molNaOH的溶液反应 |
7.以铬铁矿(主要成分是FeO•Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体的工艺流程如下:
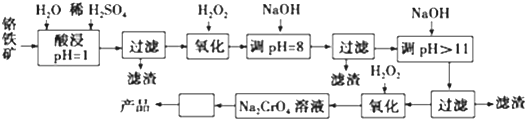
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO2-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下.
(1)流程中两次使用了H2O2,分别写出反应的离子方程式:2Fe2++H2O2+2H+═2Fe3++2H2O、2CrO2-+3H2O2+2OH-═2CrO42-+4H2O.
(2)流程图中“□”内的操作是蒸发浓缩、冷却结晶.
(3)加入NaOH调节溶液的pH=8时,被除去的离子是Fe3+、Al3+;调节溶液的pH>11时,被除去的离子是Mg2+.
(4)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?不能,当pH=8时Al3+已经完全转化为Al(OH)3,若不经过滤除去,当继续加入NaOH时Al(OH)3会溶解,引入杂质离子AlO2-.

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO2-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下.
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
(2)流程图中“□”内的操作是蒸发浓缩、冷却结晶.
(3)加入NaOH调节溶液的pH=8时,被除去的离子是Fe3+、Al3+;调节溶液的pH>11时,被除去的离子是Mg2+.
(4)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?不能,当pH=8时Al3+已经完全转化为Al(OH)3,若不经过滤除去,当继续加入NaOH时Al(OH)3会溶解,引入杂质离子AlO2-.