题目内容
9.amL三种气态烃的混合物和足量的氧气混合点燃爆炸后,恢复到原来的状态(常温常压),气体体积共缩小2amL(不考虑二氧化碳的溶解).则三种烃可能的组合是( )| A. | CH4、C2H4、C3H4任意体积比 | |
| B. | CH4、C3H6、C2H2保持C3H6:C2H2=1:2(物质的量之比) | |
| C. | CH4、C2H6、C3H8同条件下体积比为2:1:2 | |
| D. | C2H4、C3H6、C4H8任意质量比 |
分析 设烃的混合物的平均化学式为CxHy,在氧气中燃烧的化学方程式为:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(l),根据体积变化,则1:(1+$\frac{y}{4}$)=a:2a,解得y=4,即混合气体分子中平均含有4个H原子,结合选项计算判断.
解答 解:设烃的混合物的平均化学式为CxHy,则:
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(l),体积减小
1 1+$\frac{y}{4}$
amL 2amL
则1:(1+$\frac{y}{4}$)=a:2a,
解得:y=4,
即混合气体分子中平均含有4个H原子,
A.CH4、C2H4、C3H4分子均含有4个H原子,相同条件下以任意比混合平均H原子数目为4,故A正确;
B.CH4、C3H6、C2H2混合,应保持C3H6:C2H2=1:1(物质的量之比),故B错误;
C.CH4、C2H6、C3H8的平均H原子数一定大于4,故C错误;
D.C2H4、C3H6、C4H8的平均H原子数一定大于4,不符合条件,故D错误;
故选A.
点评 本题考查有关混合物反应的计算,题目难度中等,注意利用差量法与平均分子在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 正常雨水的pH值是7 | |
| B. | 冶炼金属钠用热分解法 | |
| C. | 使用过的塑料可以随意丢弃 | |
| D. | 治理水污染可以用混凝法、中和法、沉淀法等 |
20.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生反应,2A(g)═B(g)+C(g),下列说法不正确的是( )
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| A(g) | B(g) | C(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 该反应的正反应为放热反应 | |
| B. | 达到平衡时,容器Ⅰ中的A体积分数与容器Ⅱ中的相同 | |
| C. | 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短 | |
| D. | 若起始时向容器Ⅰ中充入0.15 mol A、0.15 mol B 和0.10 mol C则反应将向逆反应方向进行 |
14.下列因素中一定能引起平衡移动的是( )
| A. | 催化剂 | B. | 温度 | C. | 浓度 | D. | 压强 |
1.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 含NA个Na+的Na2OH溶解于1L水中,Na+浓度为1mol•L-1 | |
| B. | 常温常压下,11.2LH2 中含有分分子数大于0.5NA | |
| C. | 常温常压下,30.8gCCl4中含有的原子数目为NA | |
| D. | 2L0.5mol•L-1H2O2溶液中含有的氧原子数为2NA |
18.KHCO3和K2CO3分别与NaHCO3和Na2CO3性质类似,下列比较中正确的是( )
| A. | 常温下在水中溶解性比KHCO3>K2CO3 | |
| B. | 热稳定性K2CO3<KHCO3 | |
| C. | 和酸反应放出CO2的快慢KHCO3>K2CO3 | |
| D. | 等量的盐酸分别与足量KHCO3和K2CO3反应,产生CO2一样多 |
19. 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:(其中CO中的碳氧键为C$\frac{\underline{\;←\;}}{\;}$O)
由此计算△H1=-99kJ•mol-1,已知△H2=-58kJ•mol-1,则△H3=+41kJ•mol-1.
(2)在25℃、101KPa下,每充分燃烧1g CH3OH并恢复到原状态,会释放22.68KJ的热量.请写出表示甲醇燃烧热的热化学反应方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
(3)利用CO2与H2反应还可合成二甲醚(CH3OCH3).以KOH为电解质溶液,组成二甲醚空气燃料电池,该电池工作时其负极反应式是CH3OCH3-12e-+16OH-=2CO32-+11H2O.
(4)常温下,用二甲醚燃料电池电解600mL NaCl溶液,若消耗二甲醚0.23g,两极共产生气体1.344L(标准状况),溶液的pH=13.
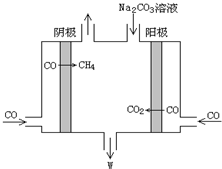
(5)若用二甲醚燃料电池电解CO制备CH4和W,工作原理如图所示,生成物WNaHCO3是,其电解总离子方程式是4CO+3CO32-+5H2O=6HCO3-+CH4↑.
 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:(其中CO中的碳氧键为C$\frac{\underline{\;←\;}}{\;}$O)
| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)在25℃、101KPa下,每充分燃烧1g CH3OH并恢复到原状态,会释放22.68KJ的热量.请写出表示甲醇燃烧热的热化学反应方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
(3)利用CO2与H2反应还可合成二甲醚(CH3OCH3).以KOH为电解质溶液,组成二甲醚空气燃料电池,该电池工作时其负极反应式是CH3OCH3-12e-+16OH-=2CO32-+11H2O.
(4)常温下,用二甲醚燃料电池电解600mL NaCl溶液,若消耗二甲醚0.23g,两极共产生气体1.344L(标准状况),溶液的pH=13.
(5)若用二甲醚燃料电池电解CO制备CH4和W,工作原理如图所示,生成物WNaHCO3是,其电解总离子方程式是4CO+3CO32-+5H2O=6HCO3-+CH4↑.
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l )的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l )的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题: