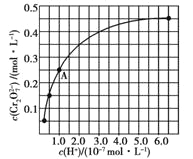
题目内容
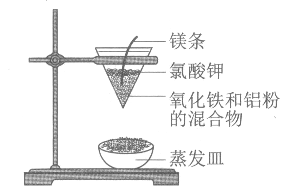
【题目】氮化铝(AlN)陶瓷是一种新型无机非金属材料,利用它较高的体积电阻率、绝缘强度大、导热性能好,可用作大功率半导体器件的绝缘基片、大规模和超大规模集成电路的散热基片和封装基片。工业上可用氮气和铝在高温下直接化合法来制备氮化铝粉体(AlN粉体在潮湿的空气中易发生水解反应)。已知:实验室可用饱和亚硝酸钠(NaNO2)溶液和氯化铵溶液共热制取氮气。现提供以下装置来模拟工业制取AlN粉体。
(1)写出实验室制取氮气的化学方程式:___________________________。
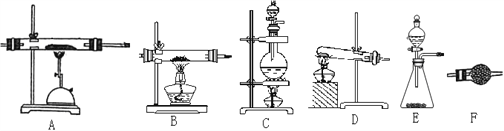
(2)请从下图中选择合适的装置按顺序组装一套用氮气和铝粉制AlN的装置(装置可以根据需要重复使用):________________________________。
(3)实验开始后应先给_______处装置加热一段时间再给另一处装置加热,这样操作的原因是:_______________。
(4)已知:氮化铝(AlN)既能溶于强酸,又能溶于强碱,试写出AlN与HCl溶液反应的化学方程为________________。
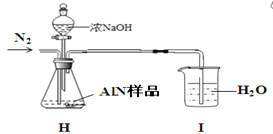
(5)AlN制备过程中存在一些副反应致生成的AlN不纯。 研究小组的同学取2.0500 g AlN样品与浓NaOH溶液充分反应,通过测定产生氨气的量来测定AlN的纯度(假设杂质与碱反应不生成NH3,忽略NH3在强碱性溶液中的溶解)。实验装置如下:请帮该同学纠正装置中一处明显错误:___________________。当H中反应完全后持续缓慢通入氮气将生成的氨全部吹入I中被水吸收。然后将I中氨水_________________________________________________________________________(请补充完这步操作,需根据后面数据计算作答),用_______取25.00mL氨水于锥形瓶中并加入几滴_______作指示剂,用0.1000mol/L的盐酸滴定至终点,消耗盐酸体积为22.50mL,经计算得AlN的纯度为90.00 %。
【答案】 NaNO2+NH4Cl=N2↑+NaCl+2H2O CFAF C 通氮气排尽装置内空气,防止氧气干扰实验 AlN+4HCl=AlCl3+NH4Cl 将I中导管改为连接一个倒扣漏斗吸收氨气 转移到500mL容量瓶中定容配成500mL溶液 碱式滴定管 甲基橙
【解析】 (1)由题意知,实验室用饱和亚硝酸钠(NaNO2)溶液和氯化铵溶液共热制取氮气,该反应的化学方程式为NaNO2+NH4Cl=N2↑+NaCl+2H2O。
(2)可以选择C作为氮气的发生装置,选择F作为氮气的干燥装置,选择A作为氮化铝的制备装置,最后再加一个F,防止空气中的水蒸气进入A装置,引起氮化铝水解。所以,可以按CFAF顺序组装一套用氮气和铝粉制AlN的装置。
(3)实验开始后应先给C处装置加热一段时间再给另一处装置加热,这样操作的原因是:通氮气排尽装置内空气,防止氧气干扰实验。
(4)由于氮化铝(AlN)既能溶于强酸,又能溶于强碱,所以AlN与HCl溶液反应可以生成两种盐,其化学方程为AlN+4HCl=AlCl3+NH4Cl。
(5) 该实验装置中的尾气处理装置设计不正确,容易引起倒吸,应将I中导管改为连接一个漏斗倒扣于烧杯水面吸收氨气。当H中反应完全后持续缓慢通入氮气将生成的氨全部吹入I中被水吸收。然后将I中氨水转移到500mL容量瓶中定容配成500mL溶液,用碱式滴定管取25.00mL氨水于锥形瓶中并加入几滴甲基橙作指示剂,用0.1000mol/L的盐酸滴定至终点,消耗盐酸体积为22.50mL,经计算得AlN的纯度为90.00 %。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案