题目内容
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
A. ②④ B. ①③ C. ③④ D. ①④
【答案】B
【解析】
①增加C(s)的量,并不改变C(s)的浓度,则反应速率不变;
②将容器的体积缩小一半,反应体系中物质的浓度增大,则化学反应速率增大;
③保持体积不变,充入氮气,氮气不参与反应,反应体系中的各物质的浓度不变,则速率不变;
④保持压强不变,充入氮气,使容器的体积变大,反应体系中各物质的浓度减小,则反应速率减小;
综上所述,符合题意的为①③;答案选B。

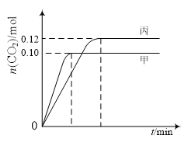
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%
【题目】(1)现有下列4种物质:①NO、②Cl2、③浓H2SO4、④NH4HCO3。其中,受热易分解的是______________;(填序号,下同);可作氧气干燥剂的是______________;属于氧化物的是______________。
(2)选择装置,完成实验。
|
|
|
A | B | C |
①用CCl4萃取碘水中的I2,选用_________________(填序号,下同)。
②配制100 mL 0.50 mol/L NaOH溶液,选用_________________。
③从NaCl溶液中获取NaCl固体,选用____________________。










