题目内容
【题目】海洋资源的利用具有广阔前景。
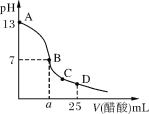
(1)无需经过化学变化就能从海水中获得的物质是___(填序号)
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)如图是从海水中提取镁的简单流程。
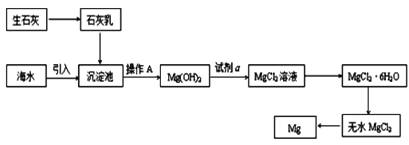
①操作 A是___。
②海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?___
(3)利用海底的“可燃冰”制作的酸性燃料电池的总反应式为:CH4+2O2=CO2+2H2O,则该燃料电池负极的电极反应式为____。
(4)海带灰中富含以 I- 形式存在的碘元素,实验室提取 I2的途径如图所示:
![]()
①灼烧海带至灰烬时所用的主要仪器是____(填序号)。
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式____。
(5)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示,a,b,c,d 括号内数据表示坐标。
CH3OH(g)+H2O(g),某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示,a,b,c,d 括号内数据表示坐标。
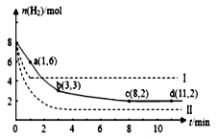
①a点正反应速率___(填“大于、等于或小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是____mol/L。
③能够说明该反应达到化学平衡状态的标志是___。
A.单位时间内消耗1molCO2,同时生成3molH2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
【答案】BD 过滤 海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,增大镁离子浓度,降低成本 CH4+2H2O-8e-=CO2+8H+ a 2H++2I-+H2O2=I2+2H2O 大于 2 AC
【解析】
(1)根据从海水制备物质的原理分析判断;
(2)海水引入沉淀池,用生石灰和水反应生成的氢氧化钙沉淀镁离子,过滤得到氢氧化镁沉淀,在沉淀中加入稀盐酸溶解得到氯化镁溶液,蒸发浓缩、结晶析出、洗涤干燥得到氯化镁晶体,在氯化氢气流中加热失去结晶水得到固体氯化镁,电解熔融氯化镁得到金属镁,据此分析解答;
(3)酸性条件下正极电极反应式为O2+4e-+4H+═2H2O,根据总反应减去正极反应式得到负极反应式;
(4)干海带灼烧成海带灰,加水溶解过滤,得到的滤液中酸化加入过氧化氢氧化碘离子生成碘单质,加入四氯化碳萃取分液分离出碘单质,据此分析解答;
(5)①a点时还没有达到平衡状态,从反应物的物质的量的变化趋势判断反应进行的方向,据此判断正逆反应速率大小;②根据图像,平衡时氢气为2mol,根据三段式计算;③根据平衡时,正逆反应速率相同,各组分含量保持不变分析判断。
(1)A.可从海水中获得氯化钠,电解氯化钠溶液或熔融氯化钠生成氯气,需要化学变化从海水中获得氯气,故A不选;B.把海水用蒸馏等方法可以得到淡水,不需要化学变化获得,故B选;C.可从海水中获得氯化钠,电解氯化钠溶液可得烧碱、氢气和氯气,需要化学变化从海水中获得烧碱,故C不选;D.可从海水中获得氯化钠,是利用氯化钠溶解度随温度变化不大,蒸发溶剂得到,不需要化学变化获得,故D选;故答案为:BD;
(2)①根据分析可知操作A为分离固体和溶液的操作为过滤,故答案为:过滤;
③海水提镁的过程中将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁,是因为海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,增大镁离子浓度,降低成本,故答案为:海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,增大镁离子浓度,降低成本;
(3)酸性条件,燃料电池总反应式:CH4+2O2═CO2+2H2O,正极电极反应式为O2+4e-+4H+═2H2O,总反应减去正极反应式得到负极反应式:CH4-8e-+2H2O═CO2+8H+,故答案为:CH4-8e-+2H2O═CO2+8H+;
(4)①灼烧固体时所用的主要仪器为坩埚,故答案为:a;
②加入过氧化氢的目的是将碘离子转化为单质碘,离子方程式为2H++2I-+H2O2═I2+2H2O,故答案为:2H++2I-+H2O2═I2+2H2O;
(5)①a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,反应继续正向进行,所以正反应速率大于逆反应速率,故答案为:大于;
②根据图像,平衡时氢气为2mol,
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始量(mol) 6 8 0 0
变化量(mol) 2 6 2 2
平衡量(mol) 4 2 2 2
平衡时CO2的物质的量浓度=![]() =2mol/L,故答案为:2;
=2mol/L,故答案为:2;
③CO2(g)+3H2(g)CH3OH(g)+H2O(g)。A.单位时间内消耗1molCO2,同时生成3mol H2,说明正逆反应速率相同,反应达到平衡状态,故A正确;B.混合气体质量不变、体积不变,混合气体的密度始终不随时间变化,不能说明反应达到平衡状态,故B错误;C.CH3OH、H2的浓度不再随时间变化是平衡的标志,故C正确;D.CH3OH和H2O浓度相等和起始量和变化量有关,不能说明正逆反应速率相同,不能说明反应达到平衡状态,故D错误;故答案为:AC。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案