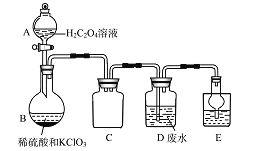
题目内容
【题目】下列计算结果正确是( )
A. 0.5L、8mol/L 浓盐酸与足量MnO2完全反应产生22.4L(标准状况下)Cl2
B. 2H2S+SO2═3S↓+2H2O反应中氧化产物与还原产物的物质的量之比为1:2
C. 将NO2和O2等体积混合充满一试管,倒置于水槽中,充分反应后,试管中剩余气体占试管容积的![]()
D. 标准状况下,用一充满HCl气体的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为![]() mol/L
mol/L
【答案】D
【解析】
A.0.5L、8mol/L的浓盐酸含有4mol氯化氢,完全反应生成1mol氯气,但是浓盐酸变成稀盐酸,反应停止,生成的氯气小于1mol,生成Cl2的分子数小于NA,故A错误;
B.该反应中S元素化合价由-2价、+4价变为0价,所以S既是氧化产物又是还原产物,氧化产物和还原产物的物质的量之比为2:1,故B错误;
C.根据4NO2+O2+2H2O══4HNO3可知,O2过量。设NO2和O2的体积各1L,则1LNO2消耗O21/4L,剩余O23/4L,所以3/4×1/2=3/8,所以试管中剩余气体占试管容积的3/8,故C错误;
D.令烧瓶的容积为VL,则氨气的体积为VL,氨气的物质的量为VL/22.4L/mol=V/22.4mol,氨水溶液的物质的量浓度为V/22.4mol/VL=1/22.4mol/L,故D正确。
故选D。

练习册系列答案
相关题目