��Ŀ����
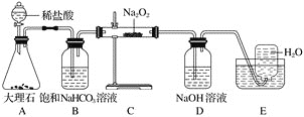
����Ŀ��Cl2����������ˮ��������Cl2��������ʱ���ɵ��л��Ȼ�����ܶ������к���ClO2������������֯(WHO)��ΪA����Ч����ȫ���������������ȡ��Cl2��Ϊ����ˮ����������ijС��̽�����ؿ�������������ԭ������֤Cl2�����ʣ����ʵ������(�г�װ����ȥ)����ش�����������

��1��Aװ���з�Ӧ������Ũ������ѻӷ��ԣ���÷�Ӧ�Ļ�ѧ����ʽΪ______________��
��2����Bװ���з�Ӧת��0.08 mol����ʱ�������ĵ�Na2O2���������Ϊ______________��
��3����Ӧ��ʼ������ͭ��������װ��D�з�����Ӧ�Ļ�ѧ����ʽΪ ______________ ��
��4��ClO2���Ʊ������Ƚ�ʵ�õ�����ʮ�֣����з����dz�������֮һ��
����һ��2NaClO3+4HCl�T2ClO2��+Cl2��+2NaCl+2H2O������0.4 mol���ӷ���ת��ʱ���õ��Ļ�ԭ����Ϊ______________mol��
��������ʵ���ҳ��������(KClO3)������(H2C2O4)��������Һ�����Ʊ���
��ͬѧ�������װ���Ʊ�ClO2�����䴦���������ӵĹ�ҵ��ˮ��
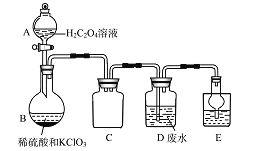
��Cװ�õ�����Ϊ______________��
��B�з�Ӧ������ClO2��CO2�ȣ�����������Ӧ�Ĺ���Ϊ��______________ �� ______________ (�û�ѧʽ��ʾ)��______________
��д��װ��D�г�ȥMn2��(��֪Mn2��ת��ΪMnO2)�����ӷ���ʽ��______________ ��
���𰸡�H2SO4(Ũ)+NaCl![]() NaHSO4+HCl��[��H2SO4(Ũ)+2NaCl
NaHSO4+HCl��[��H2SO4(Ũ)+2NaCl![]() Na2SO4+2HCl��]6.24 g4HCl+O2
Na2SO4+2HCl��]6.24 g4HCl+O2![]() 2H2O+2Cl20.4��ȫƿ��������H2C2O4��CO22ClO2+5Mn2++6H2O�T5MnO2��+2Cl-+12H+
2H2O+2Cl20.4��ȫƿ��������H2C2O4��CO22ClO2+5Mn2++6H2O�T5MnO2��+2Cl-+12H+
��������
��1��Ũ�������Ȼ��Ƽ��ȷ�Ӧ���������κ��Ȼ��⡣
��2������������ˮ��Ӧ�����������ƺ�������ת�Ƶ������������֮��Ĺ�ϵΪNa2O2��e-���ݴ˽��м��㡣
��3������ͭ������˵����ˮ���ɣ�����������ԭ��Ӧ���ɿ�֪���Ȼ�����������һ�������·�Ӧ����������ˮ��
��4������һ������2NaClO3+4HCl�T2ClO2��+Cl2��+2NaCl+2H2O��Ӧ��֪��2ClO2��2e-��ϵ���ݴ˽��м��㡣
������������װ��Ϊ��ȫƿ����ֹ������
��H2C204��KC103����Ϊ������̼������ر���ԭΪClO2��
���������Ⱦ���ǿ�������ԣ��ܹ������������������ɶ������̣���������ԭΪ���������ݴ�д�����ӷ�Ӧ����ʽ��
��1��Aװ���з�Ӧ������Ũ������ѻӷ��ԣ�Ũ�������Ȼ��Ƽ��ȷ�Ӧ���������κ��Ȼ��⣬��Ӧ�Ļ�ѧ����ʽΪ��H2SO4(Ũ)+NaCl![]() NaHSO4+HCl��[��H2SO4(Ũ)+2NaCl
NaHSO4+HCl��[��H2SO4(Ũ)+2NaCl![]() Na2SO4+2HCl��] ����ȷ����H2SO4(Ũ)+NaCl
Na2SO4+2HCl��] ����ȷ����H2SO4(Ũ)+NaCl![]() NaHSO4+HCl��[��H2SO4(Ũ)+2NaCl
NaHSO4+HCl��[��H2SO4(Ũ)+2NaCl![]() Na2SO4+2HCl��]��
Na2SO4+2HCl��]��
��2������������ˮ��Ӧ�����������ƺ�������ת�Ƶ������������֮��Ĺ�ϵΪNa2O2��e-������Ӧת��0.08 mol����ʱ�����ĵ�Na2O2�������Ϊ0.08mol������Ϊ0.08��78= 6.24 g����ȷ����6.24 g��
��3����Ӧ��ʼ������ͭ������˵����ˮ���ɣ�����������ԭ��Ӧ���ɿ�֪���Ȼ�����������һ�������·�Ӧ����������ˮ��װ��D�з�����Ӧ�Ļ�ѧ����ʽΪ��4HCl+O2![]() 2H2O+2Cl2 ����ȷ����4HCl+O2
2H2O+2Cl2 ����ȷ����4HCl+O2![]() 2H2O+2Cl2 ��
2H2O+2Cl2 ��
��4������һ������2NaClO3+4HCl�T2ClO2��+Cl2��+2NaCl+2H2O��Ӧ��֪��NaClO3��+5���ȱ���ԭ��0����NaClO3����������HCl��-1����������0����HClΪ��ԭ������˻�ԭ����ΪClO2������2ClO2��2e-��ϵ������0.4 mol���ӷ���ת��ʱ���õ��Ļ�ԭ����Ϊ0.4mol����ȷ����0.4��
��������������Cװ�ý����ܡ������ܶ��϶̿���֪��Ϊ��ȫƿ����ֹ��������ȷ������ȫƿ����������
����H2C204��Һ��ϡ�����KC103�Ʊ�ClO2��Ӧ����Ϊ�������ȡ�������̼��ϡ��Cl02�����ᱻ����Ϊ������̼������ر���ԭΪClO2����ȷ����H2C2O4��CO2��
���������Ⱦ���ǿ�������ԣ��ܹ������������������ɶ������̣���������ԭΪ�����ӣ����ӷ���ʽ��2ClO2+5Mn2++6H2O�T5MnO2��+2Cl-+12H+����ȷ����2ClO2+5Mn2++6H2O�T5MnO2��+2Cl-+12H+��

 ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�