题目内容
(15分)实验室以废铜屑为原料制取碱式碳酸铜【Cu2(OH)2CO3】的步骤如下:
步骤一:废铜屑制硝酸铜
如图,
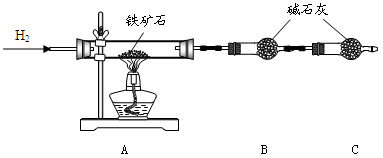
用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
步骤三:碱式碳酸铜的组成测定
碱式碳酸铜可表示为:xCuCO3 ·yCu (OH)2 ·zH2O,可采用氢气还原法来确定,其反应原理为:
xCuCO3 ·yCu (OH)2 ·zH2O + H2→ Cu + CO2 + H2O(未配平)
完成下列填空:
(1)步骤一中,反应开始时,瓶内的现象是 ,
用该装置制取硝酸铜,好处是 。
(2)步骤二中,水浴加热所需仪器有 、 (加热、夹持仪器、石棉网除外);洗涤的目的是 。
(3) 步骤三中,①以字x、y、z母为系数,配平氢气还原法的化学方程式:
xCuCO3 ·yCu (OH)2 ·zH2O+ H2→ Cu+ CO2+ H2O
②称取24.0g某碱式碳酸铜样品,充分反应后得到12.8 g残留物,生成4.4g二氧化碳和7.2g水。该样品中结晶水质量为 g,化学式为 。
步骤一:废铜屑制硝酸铜
如图,

用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
步骤三:碱式碳酸铜的组成测定
碱式碳酸铜可表示为:xCuCO3 ·yCu (OH)2 ·zH2O,可采用氢气还原法来确定,其反应原理为:
xCuCO3 ·yCu (OH)2 ·zH2O + H2→ Cu + CO2 + H2O(未配平)
完成下列填空:
(1)步骤一中,反应开始时,瓶内的现象是 ,
用该装置制取硝酸铜,好处是 。
(2)步骤二中,水浴加热所需仪器有 、 (加热、夹持仪器、石棉网除外);洗涤的目的是 。
(3) 步骤三中,①以字x、y、z母为系数,配平氢气还原法的化学方程式:
xCuCO3 ·yCu (OH)2 ·zH2O+ H2→ Cu+ CO2+ H2O
②称取24.0g某碱式碳酸铜样品,充分反应后得到12.8 g残留物,生成4.4g二氧化碳和7.2g水。该样品中结晶水质量为 g,化学式为 。
(1)气体变为红棕色,锥形瓶中溶液变蓝色; 减少氮氧化合物对环境的污染;
(2)烧杯、温度计;除去产品表面吸附的硝酸钠;
(3)①1,(x+y),(x+y),x,(x+2y+z);②1.8 ;CuCO3 ·Cu (OH)2 ·H2O。
(2)烧杯、温度计;除去产品表面吸附的硝酸钠;
(3)①1,(x+y),(x+y),x,(x+2y+z);②1.8 ;CuCO3 ·Cu (OH)2 ·H2O。
试题分析:(1)在实验步骤一中,反应开始时,会看到在Cu 溶解,锥形瓶中溶液变蓝色,气体变为红棕色。由于该实验装置是密闭的,产生的大气污染物NO2、NO会被NaOH溶液吸收,减少氮氧化合物对环境的污染;(2)在操作步骤二中,水浴加热所需仪器有烧杯、温度计;洗涤的目的是除去产品表面吸附的杂质硝酸钠;(3) ①根据元素守恒、电子守恒可得方程式为xCuCO3 ·yCu (OH)2 ·zH2O+(x+y)H2→(x+y)Cu+x CO2↑+(x+2y+z)H2O。②n(Cu)=" 12.8" g÷64g/mol=0.2mol;n(CO2)=0.1mol;n(H2O)=7.2g÷18g/mol=0.4mol。则含有CuCO3:0.1mol;含有Cu (OH)2:0.1mol;所以该样品中结晶水质量为24.0g-0.1mol×124g/mol-0.1mol×98g/mol=1.8g。所以含有的结晶水为1.8g÷18g/mol="0.1mol." CuCO3:Cu (OH)2:H2O=0.1:0.1:0.1=1:1:1。因此该碱式碳酸铜的化学式为CuCO3 ·Cu (OH)2 ·H2O。

练习册系列答案
相关题目