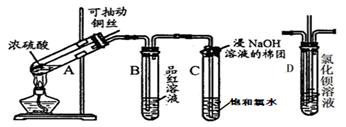
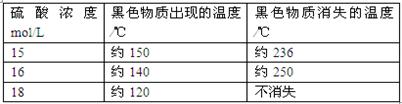
题目内容
100毫升含HNO3、H2SO4的稀溶液中,加入9.6克铜充分反应,铜全溶,产生2.24升NO(标准状况)。同体积的混合酸恰好与250毫升2mol/L的NaOH完全中和。
计算原混合酸中HNO3的物质的量浓度的取值范围_________________________
H2SO4的物质的量浓度的取值范围_______________________。
计算原混合酸中HNO3的物质的量浓度的取值范围_________________________
H2SO4的物质的量浓度的取值范围_______________________。
1 mol/L≤C(HNO3)<5 mol/L, 0<C(H2SO4)≤2 mol/L
试题分析:本题用极限法考虑,铜与混酸反应的离子方程式为3Cu+2NO3-+8H+="3" Cu 2++2NO↑+4 H2O,2.24L标准状况下的NO的物质的量是0.1mol,若硝酸全部被还原为NO,则硝酸的物质的量最小是0.1mol,浓度是1mol/L;同体积的混合酸恰好与250毫升2mol/L的NaOH完全中和,说明混酸中的氢离子的物质的量为0.5mol,若全部是硝酸提供,则硝酸的物质的量最大是0.5mol,浓度是5mol/L,所以硝酸的物质的量浓度的范围是1 mol/L≤C(HNO3)<5 mol/L;当硝酸的物质的量最小时,硫酸的物质的量最大是0.2mol,所以浓度的最大值是2mol/L,硝酸物质的量最大时,硫酸的物质的量最小为0,实际是硝酸和硫酸的混合酸,所以硫酸的浓度的取值范围是 0<C(H2SO4)≤2 mol/L。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目