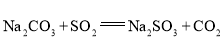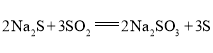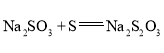题目内容
【题目】室温下,某同学进行CO2与Na2O2反应的探究实验,回答下列问题。
(1)用如图装置制备纯净的CO2
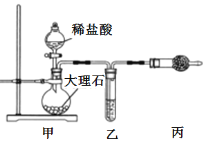
①丙装置的名称是___,乙装置中盛装的试剂是___。
②若CO2 中混有HCl,则HCl与Na2O2反应的化学方程式为____。
(2)按照下面的装置图进行实验(夹持装置略)。
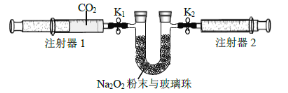
①先组装仪器,然后________,再用注射器1抽取100mL 纯净的CO2,将其连接在K1 处,注射器2的活塞推到底后连接在K2 处,具支U 形管中装入足量的Na2O2 粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞,可观察到的现象是_____。
③实验过程中反应的化学方程式为_____。
【答案】球形干燥管 饱和NaHCO3溶液 2Na2O2+4HCl=4NaCl+2H2O+O2 检查装置气密性 U形管中的淡黄色粉末逐渐变浅,注射器2的活塞向右移动 2Na2O2+2CO2 =2Na2CO3+O2
【解析】
(1)①由图可知装置丙为干燥管;根据题意制备纯净的二氧化碳,甲装置由稀盐酸与大理石反应制备二氧化碳,制得的二氧化碳中混有氯化氢气体和水蒸气,故乙装置除去氯化氢气体,选择碱性试剂,同时不吸收二氧化碳,故选择饱和碳酸氢钠溶液;
②HCl与Na2O2反应生成氯化钠、氧气和水,化学反应为:2Na2O2+4HCl=4NaCl+2H2O+O2;
(2)①有气体参与的反应前要检查装置气密性;
②打开止水夹K1、K2,向右推动注射器1 的活塞,二氧化碳与过氧化钠反应生成碳酸钠和氧气,2CO2+2Na2O2=2NaCO3+O2,气体减少,可观察到的现象是U形管中的淡黄色粉末逐渐变浅,注射器2的活塞向右移动(或外移动);
③实验过程中反应的化学方程式为2Na2O2+2CO2 =2Na2CO3+O2。

【题目】![]() 是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和
是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和![]() 。某小组设计了如下实验装置制备
。某小组设计了如下实验装置制备![]() (夹持及加热仪器略),总反应为
(夹持及加热仪器略),总反应为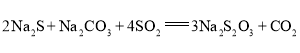 。回答下列问题:
。回答下列问题:
a.![]() b.
b.![]() 粉末 c.
粉末 c.![]() 溶液 d.
溶液 d.![]() 、
、![]() 溶液 e.
溶液 e. ![]() 溶液
溶液
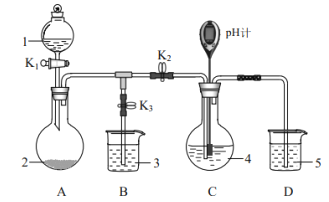
(1)装置A的作用是制备________,反应的化学方程式为________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以 |
打开 | ⅰ.导管口有气泡冒出,② ___ ⅱ. pH计读数逐渐③___ | 反应分步进行:
|
当pH计读数接近7时,立即停止通 | 必须立即停止通 |
(3)![]() 有还原性,可作脱氯剂。向
有还原性,可作脱氯剂。向![]() 溶液中通入少量
溶液中通入少量![]() ,某同学预测
,某同学预测![]() 转变为
转变为![]() ,设计实验验证该预测:取少量反应后的溶液于试管中,________。
,设计实验验证该预测:取少量反应后的溶液于试管中,________。