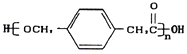
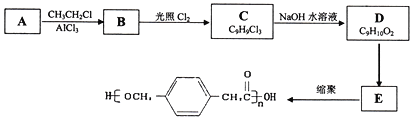
题目内容
【题目】过氧化尿素是一种新型漂白剂、消毒剂、漂白、消毒的效果优于H2O2和过氧乙酸。某工业用过氧化尿素的部分参数见下表:
分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 500g·L-1 |
合成过氧化尿素的步骤及反应器的示意图如下:在250mL三颈烧瓶中加入一定量的30%的H2O2溶液,再加入30g尿素,在不断搅拌下升温至300℃,使尿素完全溶解,保温30min,冷却至-5℃进行结晶。抽滤得白色粉末状结晶。在50℃下干燥2h,得过氧化尿素产品。回答下列问题:

(1)控制反应温度的适宜方法是__________ (填序号)。
A.酒精灯加热 B.酒精喷灯加热 C.电炉加热 D.水浴加热
(2)反应器中发生反应的化学方程式为___________________________________。
(3)反应器中冷凝管中冷水从______(填“a”或“b”)流进;反应器加热温度不能太高的原因是___________。
(4)搅拌器不能选择铁质或铝质材料的原因是_______________________________________。
(5)为测定产品中活性氧的含量(活性氧16%,相当于含H2O234%),称取干燥样品12.000g,溶解,在250mL 容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL6mol·L-1的硫酸,然后用0.2000mol·L-1KMnO4标准溶液滴定(KMnO4溶液与尿素不反应),平行实验三次,实验结果如下:
实验序号 | 1 | 2 | 3 | |
KMnO4溶液体积/mL | 滴定前读数 | 0.00 | 0.00 | 2.00 |
滴定后读数 | 19.98 | 21.70 | 22.02 | |
①KMnO4溶液应盛放在__________滴定管中,滴定终点的现象是_____________。
②产品中活性氧的质量分数为____________。
③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,会使测得的活性氧含量__________(填“偏高”“偏低”或“不变”)。
【答案】 D CO(NH2)2+H2O2=CO(NH2)2·H2O2 b 温度过高会导致过氧化氢分解 铝、铁易被氧化 酸式 滴入最后一滴KMnO4溶液时,溶液显浅红色,且半分钟内不褪色 13.3% 偏低
【解析】试题分析: (1)根据CO(NH2)2·H2O2热分解温度为45℃,分析加热方式;(2)反应器中过氧化氢与尿素发生化合反应生成CO(NH2)2·H2O2;(3) 冷凝管中冷水要低进高出;温度太高,过氧化氢会分解;(4)铁、铝具有还原性,易被氧化;(5)①高锰酸钾具有氧化性,能腐蚀橡胶;H2O2与高锰酸钾溶液反应,使高锰酸钾溶液褪色;②依据2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2;计算过氧化氢物质的量,结合题干信息计算产品中活性氧的质量分数;③依据c标准×V标准=c待测×V待测,根据标准液消耗的多少分析判断;
解析:(1)根据CO(NH2)2·H2O2热分解温度为45℃,所以采用的加热方式应用水浴加热,易于控制温度,选D;(2)反应器中过氧化氢与尿素发生化合反应生成CO(NH2)2·H2O2,反应的化学方程式为CO(NH2)2+H2O2=CO(NH2)2·H2O2;(3) 冷凝管中冷水要低进高出,所以冷凝管中冷水从b流进;过氧化氢加热会分解,所以温度不能太高;(4)铁、铝具有还原性,易被氧化,所以不能选择铁质或铝质材料搅拌器;(5)①高锰酸钾具有氧化性,腐蚀橡胶,KMnO4溶液应盛放在酸式滴定管中;H2O2与高锰酸钾溶液反应,使高锰酸钾溶液褪色,滴定终点的现象是滴入最后一滴KMnO4溶液时,溶液显浅红色,且半分钟内不褪色;②第二次实验明显误差太大,应舍去,第一次和第三次滴定平均消耗KMnO4溶液20.00mL;依据反应2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2;

所以12.000g样品中含过氧化氢0.1mol;过氧化氢质量分数=![]() ×100%=28.3%;活性氧16%,相当于H2O234%,则活性氧质量分数=
×100%=28.3%;活性氧16%,相当于H2O234%,则活性氧质量分数=![]() =13.3%,;③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,消耗高锰酸钾溶液偏小,依据c标准×V标准=c待测×V待测,则过氧化氢物质的量偏小,活性氧含量偏低。
=13.3%,;③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,消耗高锰酸钾溶液偏小,依据c标准×V标准=c待测×V待测,则过氧化氢物质的量偏小,活性氧含量偏低。