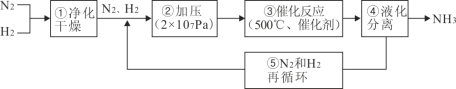
题目内容
【题目】Ti及其化合物在航天工业上有重要的应用,回答下列问题:
(1)基态Ti原子的价电子排布式为_______,基态Ti原子核外存在_______对自旋相反的电子。
(2)TiCl4熔点为23℃,沸点为136℃,TiCl4晶体属于_______晶体。TiCl4可由TiO2与COCl2在一定条件下反应得到,反应的化学方程式为_______,COCl2中共价键类型为_______,C原子的杂化轨道类型是_______,与COCl2互为等电子体的分子为_______。C、O、Cl的电负性由小到大的顺序为_______。
(3)金红石型TiO2晶胞如图,如果晶胞的边长为apm,则它的密度为_______g/cm3(列出计算式即可)。
![]()
【答案】3d24s2 10 分子 TiO2+2COCl2 TiCl4+2CO2 极性共价键 sp2杂化 BF3(其它合理答案也可) C<Cl<O
TiCl4+2CO2 极性共价键 sp2杂化 BF3(其它合理答案也可) C<Cl<O ![]()
【解析】
(1)根据核外电子排布规律分析解答;
(2)根据物质的熔沸点判断晶体类型,根据物质结构及价电子对数分析化学键类型及轨道杂化类型,根据等电子体理论分析解答;
(3)根据晶胞结构分析晶胞中原子数目,进行相关计算。
(1)Ti原子核外共有22个电子,根据核外电子排布规律分析其电子排布式为:1s2 2s2 2p6 3s2 3p6 3d2 4s2,则价电子排布式为3d24s2,除了3d轨道上是单电子外,其余都成对,则它的原子核外共有10对自旋相反的电子,故答案为:3d24s2 ;10;
(2)TiCl4熔点为23℃,沸点为136℃,熔沸点较低,则它是分子晶体;根据题给信息知TiO2与COCl2反应生成TiCl4,根据元素守恒及元素化合价变化分析产物还有CO2,则化学方程式为:TiO2+2COCl2 TiCl4+2CO2;COCl2的结构式为
TiCl4+2CO2;COCl2的结构式为![]() ,它的共价键类型为极性共价键,C原子的价电子对数为
,它的共价键类型为极性共价键,C原子的价电子对数为![]() ,则采用sp2杂化;等电子体是价电子总数和原子总数相同的粒子,与COCl2互为等电子体的分子为BF3;吸引电子能力越强,电负性越强,根据化合物中元素的化合价可以分析知,C、O、Cl的电负性由小到大的顺序为C<Cl<O;故答案为:TiO2+2COCl2
,则采用sp2杂化;等电子体是价电子总数和原子总数相同的粒子,与COCl2互为等电子体的分子为BF3;吸引电子能力越强,电负性越强,根据化合物中元素的化合价可以分析知,C、O、Cl的电负性由小到大的顺序为C<Cl<O;故答案为:TiO2+2COCl2 TiCl4+2CO2;极性共价键;sp2杂化;BF3;C<Cl<O;
TiCl4+2CO2;极性共价键;sp2杂化;BF3;C<Cl<O;
(3)由TiO2晶胞可计算出Ti原子数为![]() ,O原子数为
,O原子数为![]() ,则TiO2的密度为
,则TiO2的密度为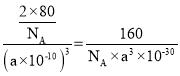 (g/cm3),故答案为:
(g/cm3),故答案为:![]() 。
。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案