题目内容
【题目】电镀行业中废水处理后产生的含重金属污泥废弃物称为电镀污泥,被列入国家危险废物名单中的第十七类危险废物。工业上可利用某电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金金属,其利用回收流程如下:

已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀的pH | 2.1 | 4.7 | 4.3 |
恰好完全沉淀的pH | 3.2 | 6.7 | a |

(1)浸出过程中的生成物主要是Fe2(SO4)3和_______________(填化学式)
(2)除铁等相关操作:
①加入石灰乳调节pH应满足要求是_______________;
②将浊液加热到80℃,趁热过滤。滤渣Ⅱ的主要成分是______________(填化学式)。
(3)还原步骤中生成Cu2O固体的离子反应方程式______________,此步骤中加入NaHSO3的不能过量______________ (离子方程式表达)。
(4)当离子浓度≤1×10-5mol·L-1时认为沉淀完全,则表格中a的值是______________。(已知:T=25℃,Ksp[Cr(OH)3]=6.3×10-31,![]() ,lg2=0.3)
,lg2=0.3)
(5)将铬块加入到稀盐酸或稀硫酸中,可观察到铬逐渐溶解,同时放出氢气。但若将铬块加稀硝酸中,却看不到明显现象。由此推测,出现该现象的可能原因是____________________________。
(6)处理大量低浓度的含铬废水(以CrO42-计)可采用离子交换法,其原理是采用季胺型强碱性阴离子交换树脂(RN—OH),使庞水中CrO42-与树脂上的OH发生离子交换反应。一段时间后停lh 通废水,再通NaOH溶液时CrO42-进入溶液回收,并使树脂得到再生。请用离子方程式表示该交换过程____________。
【答案】Cr2(SO4)3、CuSO4 3.2≤pH<4.3 Fe(OH)3、CaSO4 HSO3-+2Cu2++2H2O=Cu2O↓+SO42-+5H+ HSO3-+H+=SO2↑+H2O 5.6 金属铬在稀硝酸中发生钝化 
【解析】
(1)由Fe2O3、CuO、Cr2O3与硫酸反应分析;
(2)根据图表可知铁离子完全沉淀而铜离子不沉淀pH为 3.2≤pH<4.3,所以在除铁操作中,需要除去Fe3+和CaSO4。
(3)亚硫酸氢根离子具有强的还原性,能和铜离子之间发生反应生成硫酸根离子以及氧化亚铜;
(4)根据Ksp[Cr(OH)3]=c(Cr3+)·c3(OH-)来计算
(5)金属铬在稀硝酸中发生钝化。
(6)根据原理写出方程式:采用季胺型强碱性阴离子交换树脂(RN—OH),使庞水中CrO42-与树脂上的OH发生离子交换反应。
(1)Fe2O3、CuO、Cr2O3与硫酸反应生成Fe2(SO4)3、CuSO4、Cr2(SO4)3,浸出过程中除了生成Fe2(SO4)3外,主要还有CuSO4、Cr2(SO4)3;
(2)根据图表可知铁离子完全沉淀pH为3.2≤pH<4.3,所以在除铁操作中,需要除去Fe3+和CaSO4,相关操作:①加入石灰乳调节pH到 3.2≤pH<4.3;②将浊液加热到80℃,趁热过滤;滤渣Ⅱ的主要成分是Fe(OH)3、CaSO4 ;
(3)硫酸氢根离子具有强的还原性,能和铜离子之间发生反应生成硫酸根离子以及氧化亚铜,发生的反应为:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+ ,在酸性环境下,亚硫酸氢根离子和氢离子之间反应生成的二氧化硫具有毒性,能污染空气,HSO3-+H+=SO2↑+H2O;
(4)当离子浓度≤1×10-5 mol·L-1认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥![]() =4.0×10-9 mol·L-1,pH=14-(-lg4.0×10-9 )=5.6=a;
=4.0×10-9 mol·L-1,pH=14-(-lg4.0×10-9 )=5.6=a;
(5)金属铬在稀硝酸中发生钝化。
(6)采用季胺型强碱性阴离子交换树脂(RN—OH),使庞水中CrO42-与树脂上的OH发生离子交换反应:![]() 。
。

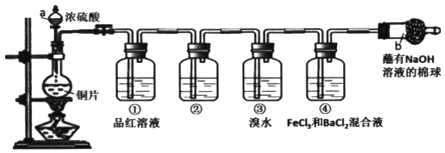
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)检查装置 A 的气密性方法是:_____。
(2)装置 B 中饱和食盐水的作用是_____;同时装置 B 亦是安全瓶,监测实验进行时 C中是否发生堵塞,请写出发生堵塞时 B 中的现象_____。
(3)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中Ⅰ、Ⅱ、Ⅲ依次放入_____。
A | B | C | D | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置 D、E 的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置 D 中少量溶液加入装置 E 中,振荡,观察到的现象是_____,该现 象_____(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是_____。