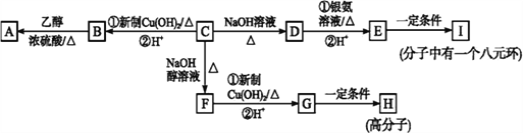
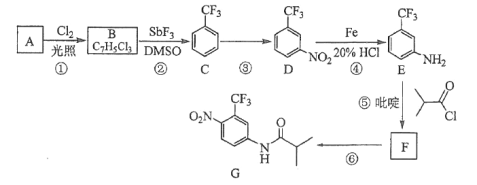
题目内容
【题目】现有A~I 9种短周期元素,它们在元素周期表中的位置如下.请据此回答下列问题:
A | ||||||||
D | E | I | ||||||
B | C | F | H | G | ||||
(1)下列中的元素的原子间反应最容易形成离子键的是
A.C和F
B.B和G
C.D和G
D.B和E
(2)下列由A~G形成的各分子中所有原子都满足最外层为8电子结构的是 .
A.EA3
B.AG
C.FG5
D.DG4
(3)由A,E组成的一种化合物化学式为EA5 , 其各原子均达到同周期稀有气体原子的稳定结构,试写出该化合物的电子式 .
(4)B,C,H,G形成的简单离子半径由大到小
(5)A与I形成1:1的化合物的结构式为
(6)写出B的最高价氧化物的水化物与G的最高价氧化物的水化物反应方程式:
写出HI2使酸性高锰酸钾褪色的离子方程式: .
【答案】
(1)B
(2)D
(3)![]()
(4)S2﹣>Cl﹣>Na+>Al3+
(5)H﹣O﹣O﹣H
(6)NaOH+Al(OH)3=NaAlO2+2H2O;5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+
【解析】解:由元素在周期表中位置知:A为H,B为Na,C为Al,D为C,E为N,F为P,I为O,H为S,G为Cl.(1)活泼金属和活泼非金属元素之间易形成离子键,这几种元素中金属性最强的是Na元素、非金属性最强的是Cl,所以B和G最容易形成离子键,故选B;(2)A.EA3为NH3 , 氢化物中H原子一定不能达到8电子结构,故A错误;B.AG为HCl,氢化物中H原子一定不能达到8电子结构,故B错误;C.PCl5分子中P元素化合价为+5价,其最外层电子数是5,5+5=10,所以该分子中并不是所有原子达到8电子结构,故C错误;D.DG4为CCl4 , C元素化合价为+4价、其最外层电子数是4,4+4=8,所以该分子中所有原子都达到8电子结构,故D正确;故选D;(3)由H、N组成的一种化合物化学式为NH5 , 其各原子均达到同周期稀有气体原子的稳定结构,该化合物化学式为NH4H,属于离子化合物,其电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径:S2﹣>Cl﹣>Na+>Al3+ , 所以答案是:S2﹣>Cl﹣>Na+>Al3+;(5)A与I形成1:1的化合物为H2O2 , 结构式为H﹣O﹣O﹣H,所以答案是:H﹣O﹣O﹣H;(6)B、G的最高价氧化物的水化物分别为NaOH、Al(OH)3 , 二者反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3=NaAlO2+2H2O,SO2被酸性高锰酸钾氧化生成硫酸,同时还原得到Mn2+ , 反应离子方程式为:5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+ , 所以答案是:NaOH+Al(OH)3=NaAlO2+2H2O;5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+ .
;(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径:S2﹣>Cl﹣>Na+>Al3+ , 所以答案是:S2﹣>Cl﹣>Na+>Al3+;(5)A与I形成1:1的化合物为H2O2 , 结构式为H﹣O﹣O﹣H,所以答案是:H﹣O﹣O﹣H;(6)B、G的最高价氧化物的水化物分别为NaOH、Al(OH)3 , 二者反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3=NaAlO2+2H2O,SO2被酸性高锰酸钾氧化生成硫酸,同时还原得到Mn2+ , 反应离子方程式为:5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+ , 所以答案是:NaOH+Al(OH)3=NaAlO2+2H2O;5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+ .