题目内容
【题目】一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2 H2(g) ![]() CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如图所示。根据题意完成下列各题:
CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如图所示。根据题意完成下列各题:
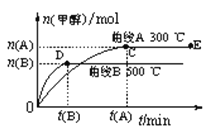
(1)反应达到平衡时,平衡常数表达式K =_______,升高温度,K值____(填“增大”、“减小”或“不变”)。
(2)500℃,从反应开始到平衡,H2的反应速率v(H2)=_____mol·(L·min)-1。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是____。
a 氢气的浓度减小 b 正反应速率加快,逆反应速率也加快c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大 e 平衡常数K增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:________(用化学方程式表示)。
【答案】![]() 减小
减小 ![]() bc Cu2O+CO
bc Cu2O+CO![]() 2Cu+CO2
2Cu+CO2
【解析】
(1)化学平衡常数是各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积之比;根据图示,升高温度,甲醇的物质的量减小,说明平衡逆向移动;
(2)根据![]() 计算从反应开始到平衡H2的反应速率;
计算从反应开始到平衡H2的反应速率;
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,压强增大,各物质的浓度均增大,根据平衡移动原理分析;
(4)反应体系中Cu2O与CO发生反应Cu2O+CO![]() 2Cu+CO2。
2Cu+CO2。
(1)化学平衡常数是各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积之比,所以反应CO(g) + 2 H2(g) ![]() CH3OH(g),平衡常数表达式K =
CH3OH(g),平衡常数表达式K =![]() ;根据图示,升高温度,甲醇的物质的量减小,说明平衡逆向移动,所以K值减小;
;根据图示,升高温度,甲醇的物质的量减小,说明平衡逆向移动,所以K值减小;
(2)500℃,达到平衡生成甲醇的物质的量是n(B),所以消耗氢气的物质的量是2n(B);![]() =
=![]() mol·(L·min)-1=
mol·(L·min)-1=![]() mol·(L·min)-1;
mol·(L·min)-1;
(3)a 、 对处于E点的体系体积压缩到原来的1/2,各物质的浓度均增大,所以氢气的浓度增大,故a错误;
b 、 对处于E点的体系体积压缩到原来的1/2,各物质的浓度均增大,正逆反应速率都加快,故b正确;
c 、 对处于E点的体系体积压缩到原来的1/2,压强增大,平衡正向移动,甲醇的物质的量增加,故c正确;
d、对处于E点的体系体积压缩到原来的1/2,压强增大,平衡正向移动,n(H2)减小、n(CH3OH)增大,所以重新平衡时n(H2)/n(CH3OH)减小,故d错误;
e 、温度不变,平衡常数K不变,故e错误;答案为bc;
(4)反应体系中Cu2O与CO发生反应Cu2O+CO![]() 2Cu+CO2,反应体系中含少量CO2,使上述平衡逆向移动,有利于维持催化剂Cu2O的量不变。
2Cu+CO2,反应体系中含少量CO2,使上述平衡逆向移动,有利于维持催化剂Cu2O的量不变。

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组欲测定 KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液,所得数据如图所示。
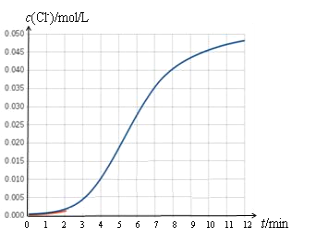
已知:ClO3 + 3HSO3=Cl + 3SO42 + 3H+
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=_________mol/(L·min)。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小。某小组同学针对这一现象进一步通过测定 c(Cl-)随时间变化的曲线探究影响因素,具体如下表所示。
方案 | 假设 | 实验操作 |
I | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液, |
II | 取10mL0.1mol/LKClO3溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL0.3mol/LNaHSO3溶液。 | |
III | 溶液酸性增强加快了化学反应速率 | 分别向2只烧杯中加入10mL0.1mol/LKClO3溶液;向烧杯①中加入1 mL水,向烧杯②中加入1mL0.2mol/L 盐酸;再分别向2只烧杯中加入10mL0.3mol/LNaHSO3溶液。 |
①补全方案I中的实验操作:_____。
②方案II中的假设为_____。
③除I、II、III中的假设外,还可以提出的假设是_____。
④在已知方案 I 的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:_____。
⑤反应后期,化学反应速率变慢的原因是_____。