题目内容
8.工业上常用氯气给自来水消毒.某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是( )| A. | AlCl3 | B. | NaOH | C. | NaHCO3 | D. | AgNO3 |
分析 自来水用氯气消毒,氯气溶液水形成氯水,依据氯水的成分分析解答.
解答 解:氯气部分溶于水,Cl2+H2O=HCl+HClO,所以溶液中存在氯气、盐酸、次氯酸等,与氯水中的物质不发生反应,
A、与氯化铝不反应,不变质,故A选;
B、NaOH与盐酸反应生成氯化钠和水,变质,故B不选;
C、NaHCO3与盐酸反应生成氯化钠、二氧化碳和水,而变质,故C不选;
D、AgNO3与盐酸反应生成难溶的氯化银,而变质,故D不选;
故选:A.
点评 本题考查溶液的成分及溶液的配制,明确氯气的性质及氯水的成分是解本题的关键,题目难度不大.

练习册系列答案
相关题目
7.现有三种碱,有关信息如下表:
将A、B、C三种碱按物质的量之比37:28:20混合均匀,测得45.28g混合碱中含B15.68g.
(1)45.28g混合碱所含A、C的质量分别为14.8g、14.8g.
(2)A与C的摩尔质量分别是40g/mol、74g/mol.
| 碱 | A | B | C |
| 化学式(X、Y为未知元素) | XOH | KOH | Y(OH)2 |
| 摩尔质量之比 | A:C=20:37 | ||
(1)45.28g混合碱所含A、C的质量分别为14.8g、14.8g.
(2)A与C的摩尔质量分别是40g/mol、74g/mol.
16.阿伏加德罗常数用NA表示,下列说法中正确的是( )
| A. | 1 mol CH3+(碳正离子)中含有质子数为8NA | |
| B. | 标准状况下,22.4 L溴单质所含原子数目为2NA | |
| C. | 常温下,100mLlmol.L-l盐酸与4.6 g钠反应生成H2分子数目为0.1 NA | |
| D. | 密闭容器盛有0.1 mol N2和0.3 mol H2在一定条件下充分反应,转移电子的数目为0.6 NA |
17.下列叙述正确的是( )
| A. | 中和pH和体积均相同的盐酸和醋酸溶液,消耗相同浓度的NaOH的体积较多的是醋酸 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液蒸干、灼烧都得到Fe2O3 | |
| C. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
18.下列说法不正确的是( )
| A. | 实验室制取Cl2时,可用饱和Na2CO3溶液除去其中的HCl | |
| B. | 新制氯水需放在棕色试剂瓶中 | |
| C. | 漂白粉漂白时,向溶液中滴入少量的盐酸,漂白效果会增强 | |
| D. | 向石蕊溶液中通入氯气,溶液先变红后褪色 |
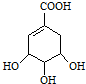 在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为不对称碳原子(或手性碳原子).具有手性碳原子的有机物具有光学活性.八角属于草本植物,主要产于中国和越南,是我国民间常用做烹调的香料.最新医学研究成果显示,从八角中可以提取到莽草酸,它是一种白色晶体,微溶于水,是制取抗禽流感药的基本原料.莽草酸的结构式如图:
在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为不对称碳原子(或手性碳原子).具有手性碳原子的有机物具有光学活性.八角属于草本植物,主要产于中国和越南,是我国民间常用做烹调的香料.最新医学研究成果显示,从八角中可以提取到莽草酸,它是一种白色晶体,微溶于水,是制取抗禽流感药的基本原料.莽草酸的结构式如图: $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$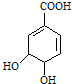 +H2O.
+H2O.