题目内容
7.现有三种碱,有关信息如下表:| 碱 | A | B | C |
| 化学式(X、Y为未知元素) | XOH | KOH | Y(OH)2 |
| 摩尔质量之比 | A:C=20:37 | ||
(1)45.28g混合碱所含A、C的质量分别为14.8g、14.8g.
(2)A与C的摩尔质量分别是40g/mol、74g/mol.
分析 根据n=$\frac{m}{M}$计算KOH物质的量,再根据物质的量之比计算A、C物质的量,结合A、C总质量及摩尔质量之比列方程计算A、C的摩尔质量,再根据m=nM计算各自质量.
解答 解:KOH物质的量为$\frac{15.68g}{56g/mol}$=0.28mol,A、B、C三种碱按物质的量之比37:28:20,则A的物质的量为0.28mol×$\frac{37}{28}$=0.37mol,C的物质的量为0.28mol×$\frac{20}{28}$=0.2mol,
设A、C的摩尔质量分别为20x g/mol、37x g/mol,则:
0.37mol×20x g/mol+0.2mol×37x g/mol=45.28g-15.68g
解得x=2,
故A的摩尔质量为40g/mol,C的摩尔质量为74g/mol,
则A的质量为0.37mol×40g/mol=14.8g,C的质量为0.2mol×74g/mol=14.8g,
故答案为:(1)14.8g;14.8g;(2)40g/mol;74g/mol.
点评 本题考查物质的量有关计算,难度不大,注意掌握以物质的量为中心的计算.

练习册系列答案
相关题目
17.下列除杂的方法正确的是( )
| A. | 除去NaCl溶液中少量CaCl2:加入适量Na2CO3,过滤 | |
| B. | 除去CO2中的少量HCl:加入Na2CO3溶液,收集气体 | |
| C. | 除去N2中的少量O2:通过灼热的CuO粉末,收集气体 | |
| D. | 除去KCl溶液中少量MgCl2: 加入适量NaOH溶液,过滤 |
18.室温时在下列溶液中.可能大量共存的一组离子( )
| A. | pH=1的溶液中:NH${\;}_{4}^{+}$、Fe3+、SO${\;}_{4}^{2-}$、I- | |
| B. | 通入SO2气体产生白色沉淀的溶液中:Fe2+、N0${\;}_{3}^{-}$、Ba2+、H+ | |
| C. | c(HCO${\;}_{3}^{-}$)=0.1 mol/L的溶液中:Al3+、Na+、AlO${\;}_{2}^{-}$、SO${\;}_{4}^{2-}$ | |
| D. | 由水电离出的c(H)+=1×10-13mol/L的溶液中:Na+、S042-、Cl-、K+ |
15.下列叙述中,正确的是( )
| A. | C4H10的一种同分异构体只能生成一种一氯代物 | |
| B. | CH3-CH=CH-C≡C-CF3分子结构中6个碳原子可能都在一条直线上 | |
| C. | 某物质的名称为:2-乙基-2-丁烯 | |
| D. | 2-丁烯存在顺反异构体 |
2.用物理方法不能把下列混合物很好地分离的是( )
| A. | 硫粉和铁粉的混合物 | B. | 氯化氢和溴化氢的混合物 | ||
| C. | 溴和CCl4的混合物 | D. | 碘与食盐的混合物 |
19.可一次性鉴别氯化镁、氯化铝、碳酸钾等三种溶液的试剂是( )
| A. | Ba(NO3)2溶液 | B. | AgNO3溶液 | C. | NaOH溶液 | D. | CH3COOH溶液 |
7.在体积为1L的两个恒容密闭容器中,分别充入1molCO和1molH2O(g)的混合气体,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
(1)1100℃时,前10min该反应的化学反应速率v(CO2)=0.025mol/(L.min),830℃平衡后CO转化率的为50%.
(2)1100℃时化学平衡常数K=$\frac{4}{9}$,该反应为放热反应(填“吸热”和“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡向正反应方向移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H2百分含量不变(选填“增大”或“减小”或“不变”).
| 0min | 10min | 20min | 30min | 40min | 50min | |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
(2)1100℃时化学平衡常数K=$\frac{4}{9}$,该反应为放热反应(填“吸热”和“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡向正反应方向移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H2百分含量不变(选填“增大”或“减小”或“不变”).
8.工业上常用氯气给自来水消毒.某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是( )
| A. | AlCl3 | B. | NaOH | C. | NaHCO3 | D. | AgNO3 |
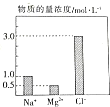 在0.2L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示.
在0.2L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示.