题目内容
某温度下,反应2A(g) B(g)+C(g)的平衡常数为1,在溶积为2L的密闭容器中加入A(g),20s时测得各组分的物质的量如下表( )
B(g)+C(g)的平衡常数为1,在溶积为2L的密闭容器中加入A(g),20s时测得各组分的物质的量如下表( )| 物质 | A(g) | B(g) | C(g) |
| 物质的量/mo1 | 1.2 | 0.6 | 0.6 |
A.反应前20s的平均速率为v(A)=0.6mo1.L-1?S-1
B.20s时,正反应速率等于逆反应速率
C.达平衡时,A(g)的转化率为100%
D.若升高温度,平衡常数将变为0.5,则反应的△H<0
【答案】分析:A、依据题干条件结合化学反应速率概念计算;速率用单位时间内难度的变化表示;
B、依据平衡常数和浓度商比较判断;
C、可逆反应不能进行彻底;依据化学平衡三段式计算分析;
D、平衡常数随温度变化,升温平衡常数减小,升温向吸热反应方向进行,说明平衡逆向进行,正向是放热反应.
解答:解:依据化学反应的三段式列式计算,
2A(g) B(g)+C(g)
B(g)+C(g)
起始量(mol) 2.4 0 0
变化量(mol) 1.2 0.6 0.6
20s末(mol) 1.2 0.6 0.6
A、反应前20s的平均速率为v(A)=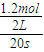 =0.03mo1.L-1?S-1,故A错误;
=0.03mo1.L-1?S-1,故A错误;
B、20S各物质浓度为:C(A)=0.6mol/L;C(B)=0.3mol/L;C(C)=0.3mol/L;Qc=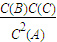 =
=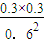 =0.25<1,说明反应未达到平衡此时正反应速率大于逆反应速率,故B错误;
=0.25<1,说明反应未达到平衡此时正反应速率大于逆反应速率,故B错误;
C、依据化学反应的三段式列式计算,设B的变化量为x,则
2A(g) B(g)+C(g)
B(g)+C(g)
起始量(mol) 2.4 0 0
变化量(mol) 2x x x
平衡量(mol) 2.4-2x x x
依据平衡常数K=1=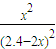
计算得到x=0.8mol,所以平衡时A的转化率=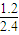 ×100%=50%,故C错误;
×100%=50%,故C错误;
D、平衡常数随温度变化,升温平衡常数减小,升温向吸热反应方向进行,说明平衡逆向进行,正向是放热反应;反应的△H<0,故D正确;
故选D.
点评:本题考查了化学平衡的计算应用,转化率、平衡常数计算,平衡判断,平衡影响因素的分析,题目难度中等.
B、依据平衡常数和浓度商比较判断;
C、可逆反应不能进行彻底;依据化学平衡三段式计算分析;
D、平衡常数随温度变化,升温平衡常数减小,升温向吸热反应方向进行,说明平衡逆向进行,正向是放热反应.
解答:解:依据化学反应的三段式列式计算,
2A(g)
 B(g)+C(g)
B(g)+C(g)起始量(mol) 2.4 0 0
变化量(mol) 1.2 0.6 0.6
20s末(mol) 1.2 0.6 0.6
A、反应前20s的平均速率为v(A)=
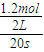 =0.03mo1.L-1?S-1,故A错误;
=0.03mo1.L-1?S-1,故A错误;B、20S各物质浓度为:C(A)=0.6mol/L;C(B)=0.3mol/L;C(C)=0.3mol/L;Qc=
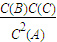 =
=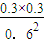 =0.25<1,说明反应未达到平衡此时正反应速率大于逆反应速率,故B错误;
=0.25<1,说明反应未达到平衡此时正反应速率大于逆反应速率,故B错误;C、依据化学反应的三段式列式计算,设B的变化量为x,则
2A(g)
 B(g)+C(g)
B(g)+C(g)起始量(mol) 2.4 0 0
变化量(mol) 2x x x
平衡量(mol) 2.4-2x x x
依据平衡常数K=1=
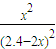
计算得到x=0.8mol,所以平衡时A的转化率=
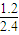 ×100%=50%,故C错误;
×100%=50%,故C错误;D、平衡常数随温度变化,升温平衡常数减小,升温向吸热反应方向进行,说明平衡逆向进行,正向是放热反应;反应的△H<0,故D正确;
故选D.
点评:本题考查了化学平衡的计算应用,转化率、平衡常数计算,平衡判断,平衡影响因素的分析,题目难度中等.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
(2013?徐州模拟)某温度下,反应2A(g)
|
某温度下,反应2A(g) B(g)+C(g)的平衡常数为1,在溶积为2L的密闭容器中加入A(g),20s时测得各组分的物质的量如下表
|
物质 |
A(g) |
B(g) |
C(g) |
|
物质的量/mo1 |
1.2 |
0.6 |
0.6 |
下列说法正确的是
A.反应前20s的平均速率为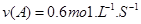
B.20s时,正反应速率等于逆反应速率
C.达平衡时,A(g)的转化率为100%
D.若升高温度,平衡常数将变为0.5,则反应的△H<0
 B(g)(正反应为吸热反应)在密闭容器中达到平衡,平衡后c(A)/c(B)=a,若改变某一条件,足够时间后反应再次达到平衡状态,此时c(A)/c(B)=b,下列叙述正确的是 ( )
B(g)(正反应为吸热反应)在密闭容器中达到平衡,平衡后c(A)/c(B)=a,若改变某一条件,足够时间后反应再次达到平衡状态,此时c(A)/c(B)=b,下列叙述正确的是 ( )