题目内容
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)步骤⑤实验操作需要烧杯、
(2)步骤②中,判断加入BaCl2已过量的方法是
(3)除杂试剂BaCl2、NaOH、Na2CO3加入的顺序还可以是(用化学式回答)

(1)步骤⑤实验操作需要烧杯、
玻璃棒
玻璃棒
、漏斗
漏斗
等玻璃仪器.(2)步骤②中,判断加入BaCl2已过量的方法是
取少量上层清液,滴加BaCl2溶液,若不再产生沉淀,即证明BaCl2已过量
取少量上层清液,滴加BaCl2溶液,若不再产生沉淀,即证明BaCl2已过量
.(3)除杂试剂BaCl2、NaOH、Na2CO3加入的顺序还可以是(用化学式回答)
NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH)
NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH)
.分析:(1)根据过滤操作要求分析;依据过滤实验用到的仪器来回答;
(2)根据钡离子能和硫酸根之间反应生成硫酸钡沉淀来检验氯化钡是否过量;
(3)碳酸钠可以将钙离子以及过量的钡离子沉淀下来;除镁离子用氢氧化钠,除钙离子用碳酸钠,除硫酸根离子用氯化钡,所加试剂要过量,为了将多余的杂质除掉,碳酸钠必须放在氯化钡的后面;
(2)根据钡离子能和硫酸根之间反应生成硫酸钡沉淀来检验氯化钡是否过量;
(3)碳酸钠可以将钙离子以及过量的钡离子沉淀下来;除镁离子用氢氧化钠,除钙离子用碳酸钠,除硫酸根离子用氯化钡,所加试剂要过量,为了将多余的杂质除掉,碳酸钠必须放在氯化钡的后面;
解答:解:(1)过滤装置是分离难溶性物质和溶液的分离方法,用到的玻璃仪器为:烧杯、玻璃棒、漏斗,
故答案为:玻璃棒;漏斗;
(2)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:取少量上层清液,滴加BaCl2溶液,若不再产生沉淀,即证明BaCl2已过量;
(3)除杂试剂为了根号除去杂质离子,一般是过量的,碳酸钠可以将钙离子以及过量的钡离子沉淀下来,BaCl2、NaOH、Na2CO3加入的顺序必须满足最后加入碳酸钠,过滤后再加盐酸制不再有气体生成即可,除杂试剂BaCl2、NaOH、Na2CO3加入的顺序还可以是NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH)
故答案为:NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH);
故答案为:玻璃棒;漏斗;
(2)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:取少量上层清液,滴加BaCl2溶液,若不再产生沉淀,即证明BaCl2已过量;
(3)除杂试剂为了根号除去杂质离子,一般是过量的,碳酸钠可以将钙离子以及过量的钡离子沉淀下来,BaCl2、NaOH、Na2CO3加入的顺序必须满足最后加入碳酸钠,过滤后再加盐酸制不再有气体生成即可,除杂试剂BaCl2、NaOH、Na2CO3加入的顺序还可以是NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH)
故答案为:NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH);
点评:本题是一道物质的分离和提纯的方法和基本操作的综合应用题,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目


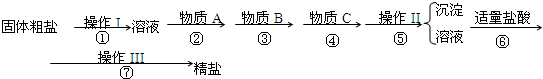
 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):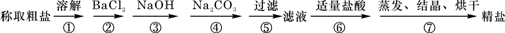

 aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液
aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液