��Ŀ����
����Ŀ�����������������ҩ�Ϳ�ϵ�Ӧ�ù㷺��
��1�������йػ����� I ��˵������ȷ����____������ĸ��ţ���
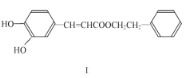
A���� FeCl3��Һ��������ɫ
B���ɷ���������Ӧ��������Ӧ
C�������巢��ȡ���ͼӳɷ�Ӧ
D��1mol ������ I ������� 2molNaOH ��Ӧ
��2����Ӧ����һ����ϩ��ֱ���Ʊ������������·����������� II �ķ���ʽΪ___________��
![]()
��3�������� II ���ɷ����廯���� III �� IV �ֱ�ͨ����ȥ��Ӧ��ã���ֻ�л����� III ���� Na ��Ӧ����H2��������III�Ľṹ��ʽΪ___________����д1�֣����ɻ�����IV���ɻ�����II�ķ�Ӧ����Ϊ___________ ��
��4���ۺ��� �������Ʊ�Ϳ�ϣ��䵥��ṹ��ʽΪ_______________���������Ʒ�Ӧ�ٵķ�����������ϩΪ�л���ԭ�Ϻϳɸõ��壬�漰��������Ӧ����ʽΪ��
�������Ʊ�Ϳ�ϣ��䵥��ṹ��ʽΪ_______________���������Ʒ�Ӧ�ٵķ�����������ϩΪ�л���ԭ�Ϻϳɸõ��壬�漰��������Ӧ����ʽΪ��
��. CH2=CH2+ H2O![]() CH3CH2OH
CH3CH2OH
��.____________ ��
���𰸡�AC C9H10 ![]() ��
�� ![]() NaOH����Һ������ CH2=CHCOOCH2CH3
NaOH����Һ������ CH2=CHCOOCH2CH3 ![]()
��������
��1��A�������� I�к��з��ǻ������� FeCl3��Һ��������ɫ��
B�������� I�в�����ȩ�������ܷ���������Ӧ��
C�������� I�к���̼̼˫���������巢��ȡ���ͼӳɷ�Ӧ��
D�������� I�к���2�����ǻ���1��������1mol ������I �������3molNaOH ��Ӧ��
��2�������� IIΪ![]() ��
��
��3�������� III ���� Na ��Ӧ���� H2������ȥ֮��IJ���Ϊ������ II������ III���д��ǻ���±����Ҳ�ܷ�����ȥ��Ӧ����̼̼˫����
��4��ϩ�������Ӿ۷�Ӧ���ɾۺ���� �ĵ���ΪCH2=CHCOOCH2CH3�����ݷ�Ӧ�ٿ�֪��2CH2=CHCOOH+ 2HOCH2CH3+2CO+O2
�ĵ���ΪCH2=CHCOOCH2CH3�����ݷ�Ӧ�ٿ�֪��2CH2=CHCOOH+ 2HOCH2CH3+2CO+O2![]() 2CH2=CHCOOCH2CH3+2 H2O��
2CH2=CHCOOCH2CH3+2 H2O��
��1��A�������� I�к��з��ǻ������� FeCl3��Һ��������ɫ���������⣬A��ȷ��
B�������� I�в�����ȩ�������ܷ���������Ӧ�������ⲻ����B����
C�������� I�к���̼̼˫���������巢��ȡ���ͼӳɷ�Ӧ���������⣬C��ȷ��
D�������� I�к���2�����ǻ���1��������1mol ������I �������3molNaOH ��Ӧ�������ⲻ����D����
��ΪAC��
��2�������� IIΪ![]() �������ʽΪC9H10��
�������ʽΪC9H10��
��3�������� III ���� Na ��Ӧ���� H2������ȥ֮��IJ���Ϊ������ II������ III���д��ǻ������� III�Ľṹ��ʽΪ![]() ��
�� ![]() ��±����Ҳ�ܷ�����ȥ��Ӧ����̼̼˫��������IV������ȥ��Ӧ������ΪNaOH����Һ�����ȣ�
��±����Ҳ�ܷ�����ȥ��Ӧ����̼̼˫��������IV������ȥ��Ӧ������ΪNaOH����Һ�����ȣ�
��4��ϩ�������Ӿ۷�Ӧ���ɾۺ���� �ĵ���ΪCH2=CHCOOCH2CH3�����ݷ�Ӧ�ٿ�֪��2CH2=CHCOOH+ 2HOCH2CH3+2CO+O2
�ĵ���ΪCH2=CHCOOCH2CH3�����ݷ�Ӧ�ٿ�֪��2CH2=CHCOOH+ 2HOCH2CH3+2CO+O2![]() 2CH2=CHCOOCH2CH3+2 H2O��
2CH2=CHCOOCH2CH3+2 H2O��

����Ŀ��2018�꣬�����˳��ˡ�����Э����ʵ���ٹ�ҵ��ս�ԣ����й�ȴ�Ӵ��˻������ȣ�����ڹ�����ҹ������εĴ���������ҹ�������ǿ��������CO2���⻯�ϳɼ״������Ĺ�ҵ�������о���ʵ�ֿɳ�����չ��
��1����֪��CO2(g)+H2(g)![]() H2O(g) +CO(g)����H1 = + 41.1 kJmol-1
H2O(g) +CO(g)����H1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g)����H2=��90.0 kJmol-1
CH3OH(g)����H2=��90.0 kJmol-1
д��CO2���⻯�ϳɼ״����Ȼ�ѧ����ʽ��_______��
��2��Ϊ���CH3OH���ʣ�������Ӧ���õ�������_______������ĸ����
a.���¸�ѹ b.���µ�ѹ c.���µ�ѹ d.���¸�ѹ
��3��250�桢�ں����ܱ���������CO2(g)���⻯�ϳ�CH3OH(g)����ͼΪ��ͬͶ�ϱ�[n(H2)/n(CO2)]ʱij��Ӧ��Xƽ��ת���ʱ仯���ߡ�

�� ��Ӧ��X��_______������CO2������H2������
�� �������_______��
��4��250�桢�����Ϊ2.0L�ĺ����ܱ������м���6mol H2��2mol CO2�ʹ�����10minʱ��Ӧ�ﵽƽ�⣬���c(CH3OH) = 0.75 mol�� L��1��
�� ǰ10min��ƽ����Ӧ����v(H2)��_______ mol��L��1��min ��1��
�� ��ѧƽ�ⳣ��K = _______��
�� �����ͷ�Ӧ�����뷴Ӧ��ת���ʺͲ����ѡ�����и߶���ء�������ͬͶ�ϱȺ���ͬ��Ӧʱ�䣬����ʵ���������£�
ʵ���� | �¶ȣ�K�� | ���� | CO2ת���ʣ�%�� | �״�ѡ���ԣ�%�� |
A | 543 | Cu/ZnO���װ� | 12.3 | 42.3 |
B | 543 | Cu/ZnO����Ƭ | 11.9 | 72.7 |
C | 553 | Cu/ZnO���װ� | 15.3 | 39.1 |
D | span>553 | Cu/ZnO����Ƭ | 12.0 | 70.6 |
�����ϱ��������ݣ���CO2�����״�������ѡ��Ϊ_______������ĸ����