题目内容
13.将SO2气体分别通入下列试剂,现象和结论均正确的是( )| 选项 | 试剂 | 现象 | 结论 |
| A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
| B | FeCl3溶液 | 溶液褪至浅绿色 | SO2有还原性 |
| C | 滴有酚酞的NaOH溶液 | 无明显变化 | SO2与NaOH溶液不反应 |
| D | 紫色石蕊试液 | 溶液变红后褪色 | SO2水溶液有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸性高锰酸钾具有强氧化性,能氧化还原性物质;
B.氯化铁具有氧化性,能氧化还原性物质;
C.二氧化硫属于酸性氧化物,能和碱反应生成盐;
D.二氧化硫具有漂白性,但不能漂白酸碱指示剂.
解答 解:A.酸性高锰酸钾具有强氧化性,能氧化还原性物质,二氧化硫具有还原性,所以能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,该反应二氧化硫体现还原性,故A错误;
B.氯化铁具有氧化性,能氧化还原性物质,二氧化硫具有还原性,二氧化硫和氯化铁反应生成硫酸根离子、亚铁离子,导致溶液由黄色变为浅绿色,二氧化硫体现还原性,故B正确;
C.二氧化硫属于酸性氧化物,能和碱反应生成盐和水,溶液碱性减弱,红色变浅,故C错误;
D.二氧化硫具有漂白性,但不能漂白酸碱指示剂,二氧化硫和水反应生成亚硫酸,亚硫酸电离出氢离子而使溶液呈酸性,紫色石蕊试液遇酸变红色,所以溶液呈红色但不褪色,故D错误;
故选B.
点评 本题考查二氧化硫性质,二氧化硫具有漂白性、氧化性和还原性,但二氧化硫不能漂白酸碱指示剂,易错选项是D,且二氧化硫漂白性具有暂时性.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
2.在碱性条件下能够大量共存,而在强酸性条件下却能发生氧化还原反应的离子组是( )
| A. | Ba2+、AlO2-、NO3-、Cl- | B. | K+、Na+、ClO-、Fe2+ | ||
| C. | Na+、I-、NO3-、SO42- | D. | NH4+、Na+、S2-、CO32- |
4.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| B. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 | |
| C. | 丙烯分子中所有原子不可能在同一平面上 | |
| D. | 蛋白质、糖类、油脂均能发生水解反应 |
1.为探究同周期元素性质的递变规律,某课外小组同学进行了如下实验:
请在下表中填写与实验步骤对应的实验现象序号:
| 实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中; 2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3.将一小段镁带投入稀盐酸中; 4.将一小片铝投入稀盐酸中. |
| 实验现象 | A.剧烈反应,迅速生成大量的气体 B.浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C.反应不剧烈,产生无色气体 D.有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | B | D | A | C |
8.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用日图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管2,再测试管2中有机层的厚度,实验记录如下:
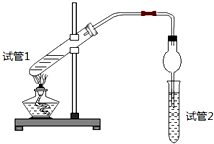 (1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH
(1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH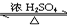 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
(2)实验D的目的是与实验C相比照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L.
(3)分析实验A(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
 (1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH
(1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH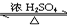 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.(2)实验D的目的是与实验C相比照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L.
(3)分析实验A(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
5.已知1~18号元素的离子cY2-、bX+、aW2+、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>d | B. | 原子半径:X<W | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 离子的还原性:Y2->Z- |
2.意大利科学家合成了一种新型氧分子,它是由四个氧原子构成的(O4),下列微粒互为同素异形体的是( )
①168O ②O2③188O ④O3 ⑤O4 ⑥O2- ⑦O22-.
①168O ②O2③188O ④O3 ⑤O4 ⑥O2- ⑦O22-.
| A. | ①③⑥ | B. | ②④⑤ | C. | ①②⑦ | D. | ④⑤⑦ |
3.50mL18mol/L的H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为( )
| A. | <0.45mol | B. | 0.45mol | ||
| C. | 0.45-0.90mol之间 | D. | >0.90mol |

 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O
+NaCl+H2O
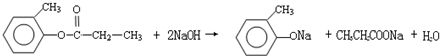 .
.