题目内容
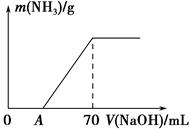
A气体极易溶于水,其相对分子质量为a,在0℃、1.01×105Pa时,测得其饱和溶液的物质的量浓度为b mol/L,该溶液的密度为c g/cm3,求:
(1)A饱和溶液中溶质的质量分数;
答:c%=
(2)0℃、1.01×105帕时,1体积水中可溶解多少体积的A气体?
答:V=
(1) ab/10c%; (2) 22400b/(1000c-ab)
解析试题分析: (1)溶液质量分数等于溶质的质量除以溶液质量,而溶质质量为物质的量乘以摩尔质量,故溶质质量为1L * bmol/L *ag/mol,溶液质量为密度乘以溶液体积,故溶液质量为cg/cm3*1000cm3所以A饱和溶液的质量分数为1L * bmol/L *ag/mol / (cg/cm3*1000cm3)*100% ="ab/10c%" =ab/1000c故A饱和溶液的质量分数ab/10c%。
(2) 1体积溶液,溶质的质量为1000(ab/1000c),而水的质量为(1-ab/1000c)/,故气体的质量就为1000(ab/1000c)/(1-ab/1000c)/a ,所以气体的物质的量为1000(ab/1000c)/(1-ab/1000c)/a 在标准状况下,气体体积为1000(ab/1000c)/(1-ab/1000c)/a*22.4 =22.4b/(c(1-ab/1000c)) ="22400bc/(c(1000c-ab))" ="22400b/(1000c-ab)" 1体积水中可溶解22400b/(1000c-ab)体积的A气体。
考点:本题主要密度,物质的量,物质的量浓度,质量分数之间转化的相关计算。

用NA表示阿伏加德罗常数,下列说法正确的是
| A.2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
| B.1mol Na2CO3晶体中含CO2- 3离子数小于1 NA |
| C.惰性电极电解食盐水,若线路中通过1 NA电子,则阳极产生气体11.2L |
| D.0.1 mol的CaO2中含阴离子数是0.2 NA |
1gN2含a个分子,则阿伏加德罗常数可表示为( )
| A.a/28mol-1 | B.a mol-1 | C.28a mol-1 | D.a/14 mol-1 |
下列各项中表达正确的是( )
| A.CO2的结构式:O—C—O |
B.乙烯分子球棍模型: |
C.NaCl的电子式: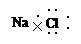 |
D.F—的结构示意图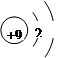 |
下列各项表达中,正确的是
A.水的电子式为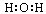 |
| B.将58g等体积的乙烯和乙烷混合物完全燃烧,生成的二氧化碳体积为89.6L |
| C.所有的氮原子中,质子数都是7个,但不一定是相同的原子 |
D.氯离子的结构示意图为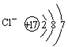 |
(8分)某同学按下列步骤配制500 mL 0.2 mol·L-1 KCl溶液,请回答有关问题。
| 实验步骤 | 有关问题 |
| ①计算所需KCl的质量 | 需要KCl的质量为________g(保留小数点后一位) |
| ②称量KCl固体 | 称量需要用到的主要仪器是________________ |
| ③将KCl加入100 mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施? ________________ |
| ④将烧杯中溶液转移至500 mL容量瓶中 | 为了防止溶液溅出,应采取什么措施? __________________ |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至离刻度线1 cm~2 cm处应如何操作?____________________ |
(2)在进行④步操作时未将洗涤烧杯、玻璃棒的洗涤液转移至容量瓶,则配制溶液浓度
________(填“偏高”、“偏低”或“不影响”)。
(3)若进行⑤步操作时加蒸馏水超过刻度线,则需________。