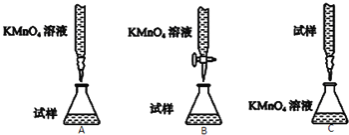
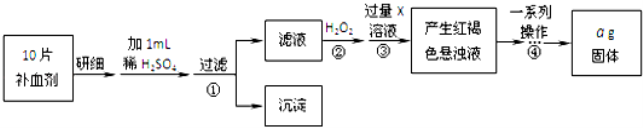
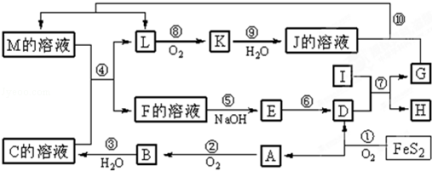
题目内容
【题目】将m g的镁、铜合金加到一定量的稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO).向反应后溶液中加入5mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金质量增加10.2g,则下列叙述正确的是( )
A.当金属全部溶解时,无法计算出参与反应的硝酸的物质的量
B.7.2<m<19.2
C.当金属全部溶解时,收集到NO气体的体积一定为4.48L
D.当生成沉淀的量达到最大值时,消耗NaOH溶液的体积为120mL
【答案】B
【解析】
试题分析:将一定量的镁和铜合金加入到稀HNO3中,二者恰好反应,金属、硝酸都没有剩余,反应中还原产物只有NO,发生反应:3Mg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加10.2g,则氢氧化镁和氢氧化铜含有氢氧根的质量为10.2g,氢氧根的物质的量为![]() =0.6mol,根据电子转移守恒,则镁和铜的总的物质的量为
=0.6mol,根据电子转移守恒,则镁和铜的总的物质的量为![]() =0.3mol,生成NO为
=0.3mol,生成NO为![]() =0.2mol;A.根据方程式可知,参加反应的n反应(HNO3)=n(金属)=×0.3mol=1.8mol,故A错误;B.镁和铜的总的物质的量为0.3mol,假定全为镁,质量为0.3mol×24g/mol=7.2g,若全为铜,质量为0.3mol×64g/mol=19.2g,所以参加反应的金属的总质量(m)为7.2g<m<19.2g,故B正确;C.温度、压强未知,不能确定气体摩尔体积,不能计算NO的体积,故C错误;D.与硝酸镁、硝酸铜反应消耗NaOH为0.6mol,该部分NaO溶液的体积为
=0.2mol;A.根据方程式可知,参加反应的n反应(HNO3)=n(金属)=×0.3mol=1.8mol,故A错误;B.镁和铜的总的物质的量为0.3mol,假定全为镁,质量为0.3mol×24g/mol=7.2g,若全为铜,质量为0.3mol×64g/mol=19.2g,所以参加反应的金属的总质量(m)为7.2g<m<19.2g,故B正确;C.温度、压强未知,不能确定气体摩尔体积,不能计算NO的体积,故C错误;D.与硝酸镁、硝酸铜反应消耗NaOH为0.6mol,该部分NaO溶液的体积为![]() =0.12L=120mL,而硝酸可能有剩余,无法计算加入的氢氧化钠溶液的体积,故D错误;故选B。
=0.12L=120mL,而硝酸可能有剩余,无法计算加入的氢氧化钠溶液的体积,故D错误;故选B。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】欲配制480mL0.5mol·L-1的NaOH溶液,试回答下列问题。
(1)计算:需要NaOH固体的质量为___________。
(2)假定最终称量小烧杯的质量为____________(填“32.6g”或“32.61g”)。
在标尺(图)上画出游码位置(画“△”表示)。
![]()
(3)某学生实际配制的NaOH溶液的浓度为0.51mol·L-1,原因可能是________。
A.使用滤纸称量NaOH固体 |
B.容量瓶中原来存有少量水 |
C.溶解后的烧杯未经多次洗涤 |
D.用胶头滴管加水定容时俯视刻度 |
E.加水时超过刻度线,用胶头滴管吸出
F.转移溶液时未经冷却
(4)假设该同学成功配制了0.400mol·L-1的盐酸,他又用该盐酸中和含100 mL的NaOH溶液,则该同学需取________mL盐酸。