题目内容
2005年诺贝尔化学奖获得者施罗克等人发现,金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为( )
①2MoS2+7O2 2MoO3+4SO2 ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O
2MoO3+4SO2 ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4C1 ④H2MoO4 MoO3+H2O
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
①2MoS2+7O2
 2MoO3+4SO2 ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O
2MoO3+4SO2 ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4C1 ④H2MoO4
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
| A.反应①和⑤都属于置换反应 |
| B.MoO3属于碱性氧化物 |
| C.在反应①中Mo和S均被氧化 |
| D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为2:2:3 |
C
一种单质与一种化合物反应,生成另外一种单质和另外一种化合物的反应是置换反应,所以选项A不正确;根据反应②可知,MoO3属于酸性氧化物,选项B不正确;在反应①中Mo和S元素的化合价都是升高的,均被氧化,正确;还原等量的MoO3,则转移的电子数是相等的,选项D不正确,答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
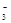 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH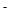 、Mg(OH)2、NO
、Mg(OH)2、NO
 +H2O→MnO
+H2O→MnO +SO
+SO +H+,下列说法不正确的是( )
+H+,下列说法不正确的是( )