题目内容
下列说法正确的是 ( )
| A.用乙醇或CCl4可提取碘水中的碘单质 |
| B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 |
| C.24Mg32S晶体中电子总数与中子总数之比为1∶1 |
| D.H2S和SiF4分子中各原子最外层都满足8电子结构 |
C
试题分析:乙醇易溶于水,不能作萃取碘的试剂,A错;NaCl为离子晶体,SiC为原子晶体,熔化时分别克服离子键和共价键,B错;氢原子最外层最多有2个电子,D错,故答案选C。
点评:该题是基础性试题的考查,也是高考中的常见题型和考点。试题贴近高考,基础性强,难易适中,注重对学生能力的培养和基础知识的训练,主要是考查学生灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣和学习积极性。

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
 -1
-1
 含中子N个,X的质量数为A,则a gX的氢化物中含质子的物质的量是( )
含中子N个,X的质量数为A,则a gX的氢化物中含质子的物质的量是( )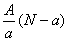 mol
mol mol
mol  mol
mol mol
mol