题目内容
【题目】锂是高能电池的理想负极,常用乙腈、二甲基甲酰胺等有机溶剂和LiC1O4、LlBF4、LiBr等电解质制成锂非水电池。回答下列问题:
(1)二甲基甲酰胺(![]() )中基态氮原子的电子排布是__,乙腈( CH3- C≡N)中碳原子的杂化轨道类型为___。
)中基态氮原子的电子排布是__,乙腈( CH3- C≡N)中碳原子的杂化轨道类型为___。
(2)LiClO4和LlBF4中都不存在的化学键是____(填代号)。
a.离子键 b.共价键 c.金属键 d.配位键
(3)LiX(X=F,Cl,Br,I)具有NaCl型晶体结构。当阴、阳离子电荷的绝对值相同且它们的半径相近时,生成的盐类一般难溶于水。由上述规则可以判断LiF、LiCl、LiBr、LiI中溶解度最小的是_______ 。
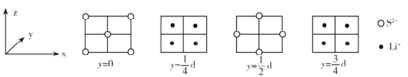
(4)Li2S属立方晶体,晶胞边长为dpm,晶胞截面图如下所示。每个晶胞中含有S2-的数目为_____,S2-的配位数是_______,NA表示阿伏加德罗常数的值,则Li2S晶体的密度为_______gcm-3(用代数式表示)。
【答案】1s2 2s22p3 sp3杂化、 sp 杂化 c LiF 4 8 ![]() × 1030
× 1030
【解析】
(1)N元素为7号元素,所以基态N原子的电子排布式为1s22s22p3;乙腈( CH3- C≡N)中甲基上的碳原子形成4个σ键,所以为sp3杂化,另一个碳原子形成碳氮三键,所以为sp杂化;
(2)LiClO4中存在锂离子和高氯酸根之间的离子键、氧原子和氯原子之间的共价键;LlBF4中存在Li+和BF![]() 之间的离子键、B原子和F原子之间的共价键,B原子最外层电子数为3,而与4个F原子成键,说明其中有一个为配位键;金属晶体中才存在金属键;综上所述,LiClO4和LlBF4中都不存在的化学键是金属键,所以选c;
之间的离子键、B原子和F原子之间的共价键,B原子最外层电子数为3,而与4个F原子成键,说明其中有一个为配位键;金属晶体中才存在金属键;综上所述,LiClO4和LlBF4中都不存在的化学键是金属键,所以选c;
(3)Li+带一个单位正电荷,有1层电子;Xˉ均带一个单位负电荷,而Fˉ、Clˉ、Brˉ、Iˉ的半径依次增大,其中与Li+半径最接近的为Fˉ,根据题意可知LiF的溶解度最小;
(4)根据晶胞截面图可知,白球即S2-位于顶点和面心,黑球即Li+位于每4个S2-形成的正四面体中心,晶胞结构如图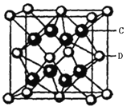 (C为Li+,D为S2-),所以每个晶胞中S2-的数目为
(C为Li+,D为S2-),所以每个晶胞中S2-的数目为![]() =4;Li+位于每4个S2-形成的正四面体中心,所以Li+的配位数为4,而晶体的化学式为Li2S,所以S2-的配位数为8;晶胞体积V=d3pm3,每个晶胞有4个S2-,8个Li+,则晶胞的质量为m=
=4;Li+位于每4个S2-形成的正四面体中心,所以Li+的配位数为4,而晶体的化学式为Li2S,所以S2-的配位数为8;晶胞体积V=d3pm3,每个晶胞有4个S2-,8个Li+,则晶胞的质量为m=![]() ,所以晶胞的密度=
,所以晶胞的密度=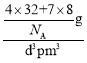 =
=![]() =
=![]() ×1030gcm-3。
×1030gcm-3。

【题目】已知下列操作和现象,所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2 (g) | 增大压强,平衡逆向移动 |
B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热;未出现银镜 | 蔗糖未水解 |
C | 向蛋白质溶液中加入CuSO4溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
D | 其他条件相同时,Na2S2O3溶液和稀H2SO4反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
A. AB. BC. CD. D
【题目】X、Y两根金属棒插入Z溶液中构成如图所示装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )

编号 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硝酸银溶液 |
A.AB.BC.CD.D