题目内容
在5L的密闭容器中进行下述反应 30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
| A.V(O2)=0.01mol·L-1·s-1 | B.V(NO)=0.08mol·L-1·s-1 |
| C.V(H2O)=0.01mol·L-1·s-1 | D.V(NH3)=0.002mol·L-1·s-1 |
D
解析试题分析:V(NO)= 0.3mol÷5L÷30S=0.002mol/(L·S);所以B错误。A V(O2 )=" 5/4×V(NO)=" 5/4×0.002mol/(L·S)= 0.0025mol/(L·S).错误。C.V(H2O)=" 5/4×V(NO)=" 6/4×0.002mol/(L·S)=0.003mol/(L·S).错误。D. V(NH3)=" V(NO)=" 0.002mol/(L·S);正确。
考点:考查化学反应速率的计算的知识。

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
下列说法正确的是( )
| A.增大压强,化学反应速率一定增大 |
| B.化学反应速率为反应时间内反应物浓度的增加或者生成物浓度的减少 |
| C.升高温度,化学反应速率一定增大 |
| D.加入反应物,化学反应速率增大 |
一定温度下,对于反应N2+O2 2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
| A.降低温度 | B.恒容充入氮气 | C.恒压充入氦气 | D.恒容充入氦气 |
在2L恒容密闭容器中充入2 mol X和lmol Y发生反应:2X(g)+Y(g) 3Z(g)△H<0, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H<0, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
| A.升高温度,平衡常数增大 |
| B.W点X的正反应速率等于M点X的正反应速率 |
| C.Q点时,Y的转化率最大 |
| D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大 |
下列措施对增大反应速率明显有效地是 ( )
| A.Na与水反应时增大水的用量 |
| B.Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
| C.在K2SO4与BaCl2两溶液反应时,增大压强 |
| D.将铝片改为铝粉,做铝与氧气反应的实验 |
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)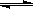 CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
| A.反应开始至a点时v(H2)=1 mol·L-1·min-1 |
| B.若曲线Ⅰ对应的条件改变是升温,则该反应?H>0 |
| C.曲线Ⅱ对应的条件改变是降低压强 |
| D.T ℃时,该反应的化学平衡常数为0.125 |
 zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是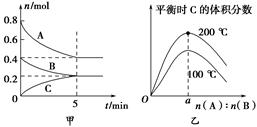
 2C,达到化学反应限度时,B的物质的量可能是( )
2C,达到化学反应限度时,B的物质的量可能是( )