题目内容
15.根据热化学方程式(在25℃、101kPa下):S(s )+O2(g)=SO2(g);△H=-297.23kJ•mol-1,分析下列说法不正确的是( )| A. | 1molS(s ) 和1molO2(g)反应生成1molSO2(g)时放出297.23kJ的热量 | |
| B. | S(g)+O2(g)=SO2(g)放出的热量大于297.23 kJ•mol-1 | |
| C. | S(g)+O2(g)=SO2(g)放出的热量小于297.23 kJ•mol-1 | |
| D. | 形成1 mol SO2的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2的化学键所吸收的总能量 |
分析 由S(s)+O2(g)═SO2(g)△H=-297.23kJ/mol,可知该反应为放热反应,S(s)=S(g)为吸热过程,由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,以此来解答.
解答 解:A.由S(s)+O2(g)═SO2(g)△H=-297.23kJ/mol,所以1molS(s ) 和1molO2(g)反应生成1molSO2(g)时放出297.23kJ的热量,故A正确;
B.由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,则放出的热量大于297.23 kJ,故B正确;
C.由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,则放出的热量大于297.23 kJ,故C错误;
D.该反应为放热反应,则形成1 mol SO2的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)的化学键所吸收的总能量,故D正确;
故选C.
点评 本题考查燃烧热的热化学反应方程式,明确燃烧的概念及反应热与键能、盖斯定律的关系即可解答,题目难度不大.

练习册系列答案
相关题目
5.下列物质中,不属于烷烃的是( )
| A. | CH4 | B. | C3H8 | C. | C10H20 | D. | C5H12 |
6.下列说法正确的是( )
| A. | SiO2 是酸性氧化物,能与氢氟酸反应 | |
| B. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
3.将一定量的氯气通入50mL 10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A. | 与NaOH反应的氯气一定为0.5 mol | |
| B. | 反应后的溶液中n(Na+)﹕n(Cl-)可能为9﹕5 | |
| C. | 若反应中转移的电子为n mol,则0.20<n<0.30 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |
10.YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于89Y的说法正确的是( )
| A. | 钇在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | 质子数与中子数之差为50 | |
| D. | 89Y和90Y是两种不同的核素 |
20.低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题. 已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如表:
请回答下列问题:
(1)上述正反应方向是放热反应(填“放热”或“吸热”).
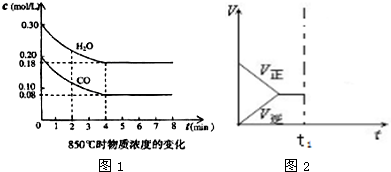
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如图1,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
t1℃时物质浓度(mol/L)的变化
(3)若在850℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO转化率为Y,试推导Y随X变化的函数关系式为X=Y
(4)t1(℃高于850)℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
①表中3min~4min之间反应处于平衡状态;理由是反应在3min和4min时的各物质浓度相同.
②表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(5)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为75%.
(6)若在500℃时该反应达到了平衡状态,此时体系中的v-t图象如图2所示,若在t1时给体系适当升高温度,则v-t图象也会随之发生变化,请把v-t图补充画全(需标明正方向的反应速率和逆方向的反应速率).
| 温度/℃ | 400 | 427 | 700 | 800 |
| 平衡常数 | 9.94 | 9 | b | 0.64 |
(1)上述正反应方向是放热反应(填“放热”或“吸热”).
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如图1,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
t1℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3[m] |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
(4)t1(℃高于850)℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
①表中3min~4min之间反应处于平衡状态;理由是反应在3min和4min时的各物质浓度相同.
②表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(5)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为75%.
(6)若在500℃时该反应达到了平衡状态,此时体系中的v-t图象如图2所示,若在t1时给体系适当升高温度,则v-t图象也会随之发生变化,请把v-t图补充画全(需标明正方向的反应速率和逆方向的反应速率).

7.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.00mol•L-1NaCl溶液中含有Na+的数目为NA | |
| B. | 常压下常温,6.4g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA | |
| C. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| D. | 7.8g过氧化钠含有的共用电子对数为0.1NA |
4.由于浓度不同而能发生不同氧化还原反应的是( )
| A. | Fe与H2SO4溶液 | B. | Fe与FeCl3溶液 | C. | Fe与HCl溶液 | D. | Fe与CuSO4 溶液 |
5.按Si、P、S、Cl的顺序递减的是( )
| A. | 单质的氧化性 | B. | 得电子能力 | C. | 氢化物的稳定性 | D. | 原子半径 |