题目内容
7.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1.00mol•L-1NaCl溶液中含有Na+的数目为NA | |
| B. | 常压下常温,6.4g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA | |
| C. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| D. | 7.8g过氧化钠含有的共用电子对数为0.1NA |
分析 A、溶液体积不明确;
B、氧气和臭氧的摩尔质量不同;
C、氯气与氢氧化钠的反应为歧化反应;
D、求出过氧化钠的物质的量,然后根据1mol过氧化钠中含1mol共用电子对来分析.
解答 解:A、溶液体积不明确,故溶液中的钠离子的个数无法计算,故A错误;
B、氧气和臭氧的摩尔质量不同,故6.4g混合物的物质的量与氧气和臭氧的比例有关,无法计算,故分子数无法计算,故B错误;
C、标况下,2.24L氯气的物质的量为0.1mol,而氯气与氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子,故0.1mol氯气转移0.1mol电子即0.1NA个,故C错误;
D、7.8g过氧化钠的物质的量为0.1mol,而1mol过氧化钠中含1mol共用电子对,故0.1mol过氧化钠中含0.1mol共用电子对即0.1NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,熟练掌握公式的运用和物质的结构是解题关键.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
17.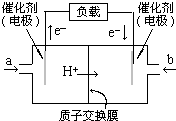 燃料电池是一种很有发展前景的电池,甲醇燃料电池的结构如图.丁烷在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2C4H10+13O2═8CO2+10H2O.下列说法中正确的是( )
燃料电池是一种很有发展前景的电池,甲醇燃料电池的结构如图.丁烷在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2C4H10+13O2═8CO2+10H2O.下列说法中正确的是( )
 燃料电池是一种很有发展前景的电池,甲醇燃料电池的结构如图.丁烷在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2C4H10+13O2═8CO2+10H2O.下列说法中正确的是( )
燃料电池是一种很有发展前景的电池,甲醇燃料电池的结构如图.丁烷在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2C4H10+13O2═8CO2+10H2O.下列说法中正确的是( )| A. | 右边的电极为电池的负极,b处通入的是空气 | |
| B. | 左边的电极为电池的负极,a处通入的是空气 | |
| C. | 电池负极的反应式为:2C4H10+16H2O-52e-═8CO2+52H+ | |
| D. | 电池的正极反应式为:13O2+26H2O+52e-═4OH- |
18.以下各条件的改变可确认发生了化学平衡移动的是( )
| A. | 由于温度的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 | |
| B. | 有气态物质参加的可逆反应达到平衡后,改变了压强 | |
| C. | 化学反应速率发生了改变 | |
| D. | 可逆反应达到平衡后,加入了催化剂 |
15.根据热化学方程式(在25℃、101kPa下):S(s )+O2(g)=SO2(g);△H=-297.23kJ•mol-1,分析下列说法不正确的是( )
| A. | 1molS(s ) 和1molO2(g)反应生成1molSO2(g)时放出297.23kJ的热量 | |
| B. | S(g)+O2(g)=SO2(g)放出的热量大于297.23 kJ•mol-1 | |
| C. | S(g)+O2(g)=SO2(g)放出的热量小于297.23 kJ•mol-1 | |
| D. | 形成1 mol SO2的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2的化学键所吸收的总能量 |
2.请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及分离方法的编号填入表中.
试剂:a.H2O b.酸性KMnO4溶液 c.Br2的CCl4溶液 d.饱和Na2CO3溶液 e.新制CaO
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 E.盐析
试剂:a.H2O b.酸性KMnO4溶液 c.Br2的CCl4溶液 d.饱和Na2CO3溶液 e.新制CaO
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 E.盐析
| 混合物 | 选择试剂 | 分离方法 |
| 二氧化硫(乙烯) | c | C |
| 乙醇(水) | e | D |
| 乙酸乙酯(乙酸) | d | A |
12.下列四组混合气体(体积比)为①NO2:O2=1:1 ②NO:O2=1:1 ③NH3:O2=1:1④NO2:NO:O2=1:1:1,将分别盛满上述各种气体的容积相等的四支试管倒置于盛有水的水槽中,最后试管内液面由低到高顺序正确的是( )
| A. | ④③②① | B. | ④①②③ | C. | ①③②④ | D. | ③①②④ |
19.下列物质在指定状态下的电离方程式正确的是( )
①水溶液 NaHSO4=Na++HSO4-②熔融状态 NaHSO4=Na++HSO4-
③水溶液中 NaHCO3=Na++HCO3-④水溶液 H3PO4?3H++PO43-
⑤水溶液 H2S+H2O?H3O++HS- ⑥水溶液 HF+H2O?H3O++F-.
①水溶液 NaHSO4=Na++HSO4-②熔融状态 NaHSO4=Na++HSO4-
③水溶液中 NaHCO3=Na++HCO3-④水溶液 H3PO4?3H++PO43-
⑤水溶液 H2S+H2O?H3O++HS- ⑥水溶液 HF+H2O?H3O++F-.
| A. | ④⑤⑥ | B. | ①③⑤ | C. | ②④⑥ | D. | ②③⑤⑥ |
16.下列物质中既含有共价键,又含有离子键的是( )
| A. | MgCl2 | B. | HClO | C. | Na2O | D. | KOH |
8. 冬青油是天然香料之一,其主要成分为水杨酸甲酯,可由水杨酸(邻羟基苯甲酸)和甲醇作原料在浓硫酸催化下酯化而得.
冬青油是天然香料之一,其主要成分为水杨酸甲酯,可由水杨酸(邻羟基苯甲酸)和甲醇作原料在浓硫酸催化下酯化而得.
实验步骤:
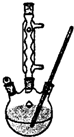
Ⅰ.如图,在100mL三口烧瓶中放入6.9g(0.05mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯,再小心地加入8mL浓硫酸,摇动混匀:加入1~2粒沸石,装上回流冷凝管在石棉网上保持85-95℃,加热回流1.5-2小时:
Ⅱ.待装置冷却后,分离出甲醇,向烧瓶中加入50mL,水,然后转移至分液漏斗,分出下层产物,弃去上层水层,有机层再倒入分液漏斗中;依次用50mL 5% NaHCO3溶液洗1次(溶液呈弱碱性),30mL水洗一次(产物皆在下层),有机层得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分.产品经0.5g无水CaCl2干燥后称重.
已知:甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出.
常用物理常数:
请根据以上信息回答下列问题:
(1)制备冬青油的化学方程式为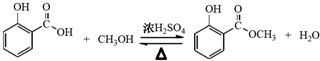 ;.
;.
(2)制备冬青油时,最合适的加热方法是水浴加热.实验中加入甲苯作带水剂的目的是反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率.
(3)反应结束冷却后,分离甲醇的操作是:蒸馏;
(4)在提纯粗产品的过程中,用碳酸氢钠溶液洗涤主要除去的杂质是水杨酸:若改用氢氧化钠溶液是否可以不可以(填“可以”或“不可以”),其原因是在氢氧化钠溶液中水杨酸甲酯发生水解.
(5)检验产品中是否含有水杨酸的化学方法是取少量晶体于试管中,加蒸馏水溶解,滴加NaHCO3溶液,若出现无色气泡则含水杨酸.最终称得产品的质量为4.2g,则所得水杨酸甲酯的产率为55%(保留两位有效数字).
 冬青油是天然香料之一,其主要成分为水杨酸甲酯,可由水杨酸(邻羟基苯甲酸)和甲醇作原料在浓硫酸催化下酯化而得.
冬青油是天然香料之一,其主要成分为水杨酸甲酯,可由水杨酸(邻羟基苯甲酸)和甲醇作原料在浓硫酸催化下酯化而得.实验步骤:
Ⅰ.如图,在100mL三口烧瓶中放入6.9g(0.05mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯,再小心地加入8mL浓硫酸,摇动混匀:加入1~2粒沸石,装上回流冷凝管在石棉网上保持85-95℃,加热回流1.5-2小时:
Ⅱ.待装置冷却后,分离出甲醇,向烧瓶中加入50mL,水,然后转移至分液漏斗,分出下层产物,弃去上层水层,有机层再倒入分液漏斗中;依次用50mL 5% NaHCO3溶液洗1次(溶液呈弱碱性),30mL水洗一次(产物皆在下层),有机层得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分.产品经0.5g无水CaCl2干燥后称重.
已知:甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出.
常用物理常数:
| 名称 | 相对分子质量 | 相对密度 | 熔点(℃) | 沸点(℃) | 溶解度 |
| 水杨酸甲酯 | 152 | 1.5369 | -8.6 | 223.3 | 微溶 |
| 水杨酸 | 138 | 1.44 | 157 | 211 | 1.5g/L |
| 甲醇 | 32 | 0.79 | -97.8 | 64.5 | 混溶 |
(1)制备冬青油的化学方程式为
 ;.
;.(2)制备冬青油时,最合适的加热方法是水浴加热.实验中加入甲苯作带水剂的目的是反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率.
(3)反应结束冷却后,分离甲醇的操作是:蒸馏;
(4)在提纯粗产品的过程中,用碳酸氢钠溶液洗涤主要除去的杂质是水杨酸:若改用氢氧化钠溶液是否可以不可以(填“可以”或“不可以”),其原因是在氢氧化钠溶液中水杨酸甲酯发生水解.
(5)检验产品中是否含有水杨酸的化学方法是取少量晶体于试管中,加蒸馏水溶解,滴加NaHCO3溶液,若出现无色气泡则含水杨酸.最终称得产品的质量为4.2g,则所得水杨酸甲酯的产率为55%(保留两位有效数字).