题目内容
【题目】目前,我国是最大的钢铁生产国,钢铁是国民经济的基础产业,铁及其化合物的应用也越来越广泛。回答下列问题:
(1)画出铁的原子结构示意图:______________。
(2)工业炼铁时常用CO还原铁矿粉,已知:
① Fe2O3(s) + 3CO(g)=2Fe(s)+ 3CO2(g) △H=-24.8 kJ/mol
② Fe3O4(S)+CO(g)=-3FeO(g)+CO2(g) △H= +19.4 kJ/mol
③ FeO(s)+CO(g)=Fe(s)+CO2(g) △H= -11.0 kJ/mol
则反应3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)的△H= ________。
(3)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) 反应温度与K的关系如右表:
反应温度/℃ | 1000 | 1150 | 1300 |
平衡常数K | 64 | 50.7 | 42.9 |
恒温1000℃在体积为10L的恒容密闭容器中加入0.1molFe2O3和0.1molCO,气体混合物中CO2的体积分数φ(CO2)随时间t的变化关系如图所示。

①前 8minCO 的反应速率为_______;平衡时a=____。
②若再向平衡混合物中加入0.01molCO 和0.02molCO2,平衡_______移动;若要使平衡混合气中CO2的体积分数增大,下列措施可行的是_______(填标号)。
A.增大Fe2O3用量 B.增大压强 C.降低温度 D.向容器中再充入少量CO
(4)纳米级的Fe3O4在催化剂、造影成像、药物载体、靶向给药等领域都有很好的应用前景,工业生产中常用“共沉淀法”来制备。将FeCl2和FeCl3按一定比例配成混合溶液,用NaOH溶液作为沉淀剂,在特定条件下即可制得纳米级的Fe3O4,反应的离子方程式是_____,在实际生产中Fe2+和Fe3+反应用量比常是2:3,甚至1:1,为什么?________。
(5)纳米铁粉可用于除去废水中的NO3-,反应的离子方程式为:4Fe+ NO3-+ 10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是________;若加入少量Cu2+,废水中NO3-的去除速率大大加快,可能的原因是_____________。
【答案】 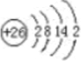 -47.2 kJ/mol 10-3 mol·L-1·min-1 80%或0.8 向正反应方向 C Fe2++2Fe3++8OH-
-47.2 kJ/mol 10-3 mol·L-1·min-1 80%或0.8 向正反应方向 C Fe2++2Fe3++8OH-![]() Fe3O4+4H2O Fe2+容易被空气中的O2氧化为Fe3+,故需多加一些Fe2+,确保生成Fe3O4 发生副反应,Fe与H+生成H2 形成的Fe-Cu原电池增大了纳米铁粉去除NO的反应速率(或Cu2+对纳米铁粉去除NO的反应具有催化作用)
Fe3O4+4H2O Fe2+容易被空气中的O2氧化为Fe3+,故需多加一些Fe2+,确保生成Fe3O4 发生副反应,Fe与H+生成H2 形成的Fe-Cu原电池增大了纳米铁粉去除NO的反应速率(或Cu2+对纳米铁粉去除NO的反应具有催化作用)
【解析】本题主要考查铁及其化合物的性质。
(1)铁的原子结构示意图: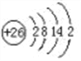 。
。
(2)3①-2②-6③得3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2mol/kJ。
(3)①K=c3(CO2)/ c3(CO)=64,c(CO2)=4c(CO)=0.008mol/L,前8minCO的反应速率为0.008/8 mol·L-1·min-1=10-3 mol·L-1·min-1;平衡时a=0.08/0.1=80%或0.8。
②若再向平衡混合物中加入0.01molCO和0.02molCO2,浓度商Q<K,平衡向右移动;若要使平衡混合气中CO2的体积分数增大,下列措施可行的是C。A.增大固体用量平衡不移动,平衡混合气中CO2的体积分数不变;B.增大压强平衡不移动,平衡混合气中CO2的体积分数不变; C.降低温度平衡右移,平衡混合气中CO2的体积分数增大;D.向容器中再充入少量CO,平衡不移动,平衡混合气中CO2的体积分数不变。故选C。
(4)反应的离子方程式是Fe2++2Fe3++8OH-![]() Fe3O4+4H2O,在实际生产中Fe2+和Fe3+反应用量比常是2:3,甚至1:1,为什么?原因是Fe2+容易被空气中的O2氧化为Fe3+,故需多加一些Fe2+,确保生成Fe3O4。
Fe3O4+4H2O,在实际生产中Fe2+和Fe3+反应用量比常是2:3,甚至1:1,为什么?原因是Fe2+容易被空气中的O2氧化为Fe3+,故需多加一些Fe2+,确保生成Fe3O4。
(5)纳米铁粉可用于除去废水中的NO3-,若pH偏低将会导致NO3-的去除率下降,其原因是发生副反应,Fe与H+生成H2;若加入少量Cu2+,废水中NO3-的去除速率大大加快,可能的原因是形成的Fe-Cu原电池增大了纳米铁粉去除NO的反应速率(或Cu2+对纳米铁粉去除NO的反应具有催化作用)。

【题目】如表所示,为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法不正确的是
选项 | 不纯物质 | 除杂试剂与主要分离方法 |
A | 甲烷(乙烯) | 溴水 洗气 |
B | 己烷(癸烷) | 蒸馏(不需试剂) |
C | 乙酸乙酯(乙酸) | KOH溶液 分液 |
D | 蛋白质溶液(NaCl) | 水 渗析 |
A. A B. B C. C D. D




