题目内容
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀pH | 沉淀完全pH | 物质 | 20℃溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-6 |
(1)将粉碎的含镍废料酸浸时要不断搅拌,粉碎和搅拌的目的是________________。
(2)调节pH步骤中,溶液pH的调节范围是__________________________________。
(3)滤渣1和滤渣3主要成分的化学式分别是________________,_____________。
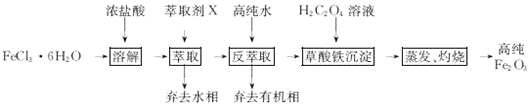
(4)氧化步骤中加入H2O2发生反应的离子方程式为____________________________。
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。该反应的化学方程式为____________________。
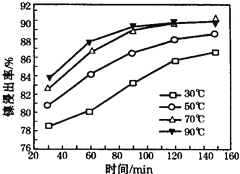
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为:
【答案】 增大接触面积,提高浸出速率和产率(或浸出率) 5.0≤pH<6.7 SiO2、CaSO4 CaF2 2Fe2+ + H2O2 +2H+ == 2Fe3+ + 2H2O NiS + H2SO4 + 2HNO3 == NiSO4 + SO2↑+ 2NO↑ + 2H2O 70 120
【解析】含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2将亚铁离子氧化为Fe3+,再加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,调节pH的范围5.0≤pH<6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体;
(1)将粉碎的含镍废料酸浸时要不断搅拌,粉碎和搅拌的目的是:增大接触面积,提高浸出速率和产率(或浸出率);(2)调节pH使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,根据表中数据,调节pH的范围为5.0≤pH<6.7;(3)滤渣1和滤渣3主要成分的化学式分别是:滤渣1为SiO2、CaSO4 ,滤渣3为CaF2;(4)溶液中的亚铁离子不容易转化为沉淀,加H2O2把亚铁离子氧化为Fe3+,起反应的离子方式为:2Fe2++H2O2+2H+═2Fe3++2H2O;(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体,即生成NO和SO2,该反应的化学方程式为 NiS + H2SO4 + 2HNO3 == NiSO4 + SO2↑+ 2NO↑ + 2H2O;(6)由图象可知,为70℃、120min时,镍浸出率最高。

【题目】下图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
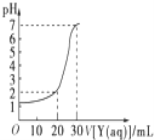
A | B | C | D | |
HCl(mol/L) | 0.12 | 0.04 | 0.09 | 0.12 |
NaOH(mol/L) | 0.04 | 0.12 | 0.03 | 0.06 |
A. A B. B C. C D. D
【题目】除去下列括号内的杂质,所加试剂和操作均正确的是
选项 | 需除杂的物质 | 试剂 | 操作 |
A | Cl2(HCl) | 饱和食盐水 | 洗气 |
B | NaBr溶液(NaI) | Cl2 | 洗气 |
C | Cl2(H2O) | 碱石灰 | 洗气 |
D | HNO3溶液(H2SO4) | BaCl 2溶液 | 过滤 |
A.AB.BC.CD.D