题目内容
【题目】(14分)用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:
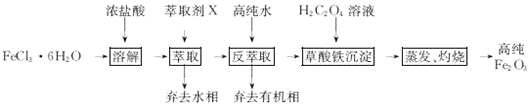
已知:HCl(浓)+FeCl3![]() HFeCl4
HFeCl4
试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
①Ca、Mn、Cu等杂质离子几乎都在 (填“水”或“有机”)相。
②若实验时共用萃取剂X 120 mL,萃取率最高的方法是 (填字母)。
a.一次性萃取,120 mL
b.分2次萃取,每次60 mL
c.分3次萃取,每次40 mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是 (写化学式);反萃取能发生的原因是 。
(3)所得草酸铁沉淀需用冰水洗涤,其目的是 。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式,并用单线桥标出电子转移的方向和数目 。
【答案】(14分,每空2分)(1)水 ,c ; (2)FeCl3,加高纯水时,酸度降低,平衡向转化为FeCl3的方向移动
(3)除去杂质、减少草酸铁晶体的溶解损耗
(4)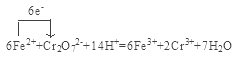 (4分)
(4分)
【解析】
试题(1)用萃取剂X萃取,该步骤中:①Ca、Mn、Cu等杂质离子都容易溶于水,而难溶于有机物,所以这些离子几乎都在水相中;②若实验时共用萃取剂X 120 mL,萃取率最高的方法是少量多次,故应该是分3次萃取,每次40 mL,选项是C;(2)用高纯水反萃取,萃取后水相中铁的存在形式是FeCl3,反萃取能发生的原因是加高纯水时,酸度降低,平衡向转化为FeCl3的方向移动;(3)所得草酸铁沉淀需用冰水洗涤,其目的是既除去了杂质,又减少草酸铁晶体的溶解损耗;(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,根据电子守恒、电荷守恒及原子守恒可得该反应的方程式,用单线桥标出电子转移的方向和数目是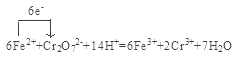 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀pH | 沉淀完全pH | 物质 | 20℃溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-6 |
(1)将粉碎的含镍废料酸浸时要不断搅拌,粉碎和搅拌的目的是________________。
(2)调节pH步骤中,溶液pH的调节范围是__________________________________。
(3)滤渣1和滤渣3主要成分的化学式分别是________________,_____________。
(4)氧化步骤中加入H2O2发生反应的离子方程式为____________________________。
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。该反应的化学方程式为____________________。
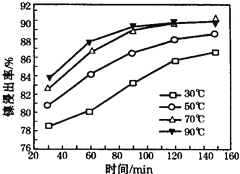
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为:
【题目】某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验Ⅰ】试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________。
(2)产生气泡的原因是____________________。
【实验Ⅱ】 试剂:未酸化的0.5 mol·L-1FeSO4溶液(pH = 3),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2 mL5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH=1.4 |
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是________。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+ 氧化的产物发生了水解
① 根据实验II记录否定假设i,理由是________。
② 实验验证假设ii:取Fe2(SO4)3溶液加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是________。
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是________。
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与________(至少写两点)有关。

