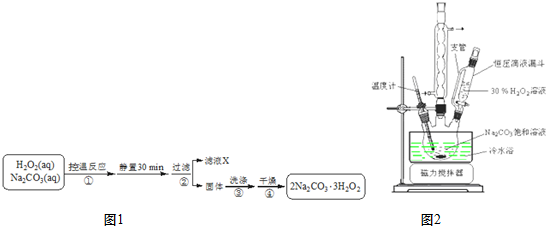
题目内容
20.在密闭容器中发生3X(g)+Y(g)?Z (g)+2W(g)反应,现在控制下列三种不同的条件:
①在400℃时,9molX与3molY反应
②在400℃时,15molX与5molY反应
③在300℃时,9molX与3molY反应
那么,反应开始时,正反应速率最大的是②.(填序号),正反应速率最小的是③.
分析 因其他条件相同时,根据温度越高,化学反应速率越大、浓度越大,化学反应速率越大来解题;
解答 解:因其他条件相同时,温度越高,化学反应速率越大,故①>③;其他条件相同时,反应物的浓度越大,化学反应速率越大,故②>①;故答案为:②;③;
点评 本题主要考查了影响化学反应速率的因素,需要注意的是因其他条件相同时,根据温度越高,化学反应速率越大、浓度越大,化学反应速率越大.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
10.下列有关核外电子排布的式子不正确的是( )
| A. | 24Cr的电子排布式:1s22s22p63s23p63d54s1 | |
| B. | K的价电子排布式:4s1 | |
| C. | 氮原子的轨道表示式: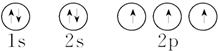 | |
| D. | 硫原子的轨道表示式: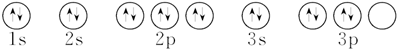 |
5.有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2mol•L-1盐酸溶液、2mol•L-1 NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、
无水乙醇
限选试剂:蒸馏水、2mol•L-1盐酸溶液、2mol•L-1 NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、
无水乙醇
| 实验步骤 | 实验结论 |
(1)A的质谱图如下: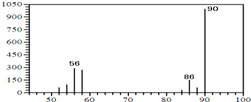 | (1)证明A的相对分子质量为90. |
| (2)将此9.0g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (2)证明A的分子式为: C3H6O3. |
| (3)另取两份9.0g A分置于不同的试管中.往其中一份A中加入足量的NaHCO3粉末充分反应,生成2.24 L CO2(标准状况). 往另一份A中加入足量金属钠充分反应,生成2.24 L H2(标准状况). | (3)证明A的分子中含有羧基和羟基官能团. |
(4)A的核磁共振氢谱如图: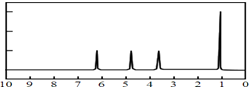 | (4)A的结构简式为: . . |
12.下表是元素周期表的一部分,针对a~k十一种元素回答下列问题(请用具体化学式回答,否则不给分):
元素周期表
(1)这些元素中非金属性最强的单质是F2,最高价氧化物对应水化物酸性最强的是HClO4,最高价氧化物对应水化物碱性最强是NaOH.
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)写出i的氧化物与强碱反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
元素周期表
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)写出i的氧化物与强碱反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
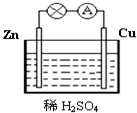 图为原电池的示意图.请回答:
图为原电池的示意图.请回答: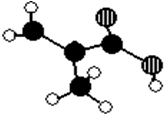 某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).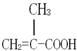 ,含有的官能团名称碳碳双键,羧基.
,含有的官能团名称碳碳双键,羧基. .
.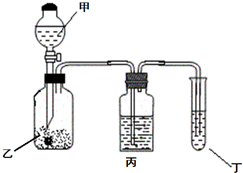 五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:
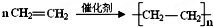 .
.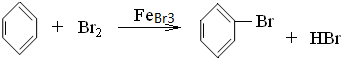 .
.