题目内容
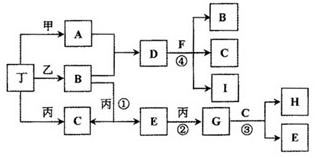
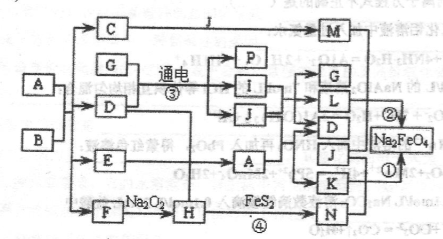
已知常温下B、D、E、L为密度比空气大的气体,D、E为单质,其他为化合物。A是一种淡黄色固体,C微溶于水,F、G均能与L的水溶液反应放出B。据下边反应框图填空。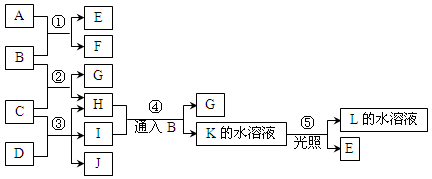
(1)F的俗名是 ,B分子的结构式为________工业上利用反应③生产 。
(2)反应④的离子方程式为 。
(3)有一种单质能与H反应生成E,该反应的化学方程式为 。
(4)某气体M具有漂白作用,既有氧化性,又有还原性,M通入D的溶液中反应的离子方程式为 。
(1)纯碱或苏打(1分),O=C=O (1分)漂白粉(1分)
(2)Ca2++2ClO-+CO2+H2O=CaCO3+2HClO(2分)
(3)2F2+2H2O=4HF+O2(2分)
(4)SO2+Cl2+2H2O=SO42-+2Cl-+4H+(2分)
解析试题分析:A是一种淡黄色固体,且A是化合物,所以A是过氧化钠。A和B反应生成E和F,其中B、D、E、L为密度比空气大的气体,D、E为单质,所以B是CO2,E是氧气,F是碳酸钠。C微溶于水,F、G均能与L的水溶液反应放出B,这说明L应该是酸,因此L是氯化氢。C是氢氧化钙,氢氧化钙和CO2反应生成碳酸钙和水,即H是水。将CO2通入到I的水溶液中生成碳酸钙和K,K光照生成氯化氢和氧气,这说明K是次氯酸,所以I是次氯酸钙,J是氯化钙,D是氯气。
(1)碳酸钠的俗名是纯碱或苏大,CO2分子中含有碳氧双键,其结构式为O=C=O ,氯气与氢氧化钙反应可以制备漂白粉,所以工业上利用反应③生产漂白粉。
(2)碳酸的酸性强于次氯酸,因此CO2通入到次氯酸钙溶液中生成次氯酸,所以反应④的离子方程式为Ca2++2ClO-+CO2+H2O=CaCO3+2HClO。
(3)能和水反应生成氧气的单质可以是单质氟,反应的化学方程式为2F2+2H2O=4HF+O2。
(4)M具有漂白作用,既有氧化性,又有还原性,所以M是SO2,与氯气在水溶液中反应的离子方程式为SO2+Cl2+2H2O=SO42-+2Cl-+4H+。
考点:考查无机框图题的有关判断和应用

 科学实验活动册系列答案
科学实验活动册系列答案下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是【用化学式表示】 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为 ,N→⑥的单质的化学方程式为 。
教材中下列图示物质对应的主要成分错误的是
| | A | B | C | D |
| 物质 |  |  |  |  |
| 主要 成分 | Fe2O3 | S | 硅酸盐 | 烃 |
下列图示实验现象及其解释不正确的是( )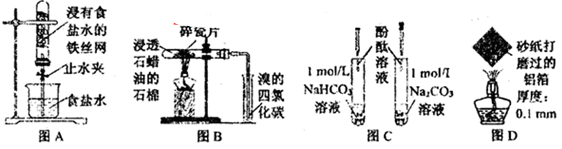
| A.图A,一段时间后打开止水夹,观察到导管中液面上升,因为铁发生了吸氧腐蚀 |
| B.图B,加热一段时间,观察到溴的四氯化碳溶液颜色褪去,因为有气态烯烃产生 |
| C.图C,溶液均变红,碳酸钠溶液颜色较深,因为相同条件下水解能力HCO3-强于CO32- |
| D.图D,加热一段时间,观察到熔化的铝未滴落,因为铝表面生成氧化铝的熔点很高 |
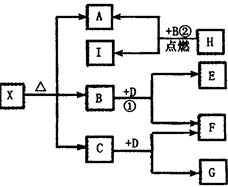

 (3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);