题目内容
【题目】几种有机物的相互转化图如下:
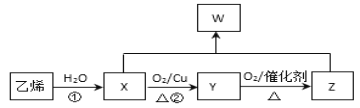
请回答:
(1)乙烯的电子式是______________________。
(2)反应①的反应类型是____________________。
(3)X→Y的化学方程式是___________________________。
(4)X+Z→W的化学方程式是_________________________________,实验室常用下图所示的装置实现这一转化。
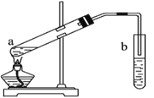
试管b中一般加入_________________________溶液,从试管b中分离出W的方法是_______。
【答案】![]() 加成反应2CH3CH2OH+O2
加成反应2CH3CH2OH+O2![]() 2CH3CHO+2H2OCH3COOH+C2H5OH
2CH3CHO+2H2OCH3COOH+C2H5OH![]() CH3COOC2H5+H2O饱和碳酸钠溶液分液
CH3COOC2H5+H2O饱和碳酸钠溶液分液
【解析】
由图中转化可知,乙烯与水发生加成反应生成X为CH3CH2OH,X催化氧化生成Y,Y为CH3CHO,Y氧化生成Z,Z为CH3COOH,X与Z发生酯化反应生成W,W为CH3COOC2H5,以此来解答。
(1)乙烯的电子式为![]() ,故答案为
,故答案为![]() ;
;
(2)根据上述分析,反应①为乙烯与水的加成反应,故答案为:加成反应;
(3)X→Y的化学方程式是2CH3CH2OH+O2![]() 2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(4)X+Z→W的方程式是CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,由图可知,试管b中一般加入饱和碳酸钠溶液,可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,便于分层,乙酸乙酯在水中溶解度较小,会产生分层,因此从试管b中分离出乙酸乙酯的方法是分液,故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O,由图可知,试管b中一般加入饱和碳酸钠溶液,可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,便于分层,乙酸乙酯在水中溶解度较小,会产生分层,因此从试管b中分离出乙酸乙酯的方法是分液,故答案为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;饱和碳酸钠;分液。
CH3COOC2H5+H2O;饱和碳酸钠;分液。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目