��Ŀ����
����Ŀ��CuSO4��Cu(NO3)2����Ȼ������Ҫ��ͭ�Ρ��ش��������⣺
��1��CuSO4��Cu(NO3)2�������ӻ�̬��������Ų�ʽΪ_________��S��O��N����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ_________��
��2����Cu(NO3)2��Һ��ͨ������NH3�����������[Cu(NH3)4] (NO3)2������NO3-����ԭ�ӵ��ӻ��������Ϊ_________��[Cu(NH3)4]NO3)2�д��ڵĻ�ѧ�����ͳ��˼��Թ��ۼ��⣬����_________��
��3��������ͭ��Һ�м������KCN������������[Cu(CN)4]2-,CN-���ṩ�µ��ӶԵ�ԭ����_________�� lmol CN-�к��еĦм�����ĿΪ_________����CN-��Ϊ�ȵ������������_________ ��д��һ�ּ��ɣ�
��4��CuSO4���۵�Ϊ560��C��,Cu(NO3)2���ܵ�Ϊ115��C,CuSO4�ܵ���ߵ�ԭ����_________��
��5������CuSO4��NaOH�Ʊ���Cu(OH)2����ȩ��ʱ�����ɺ�ɫ��Cu2O ,�侧���ṹ��ͼ��ʾ��
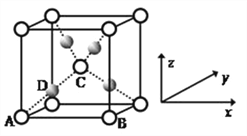
�þ���ԭ���������AΪ��0��0��0)��BΪ��1��0��0) ��CΪ��![]() ��
��![]() ��
��![]() ������Dԭ�ӵ��������Ϊ_________��������_________ԭ��(��Ԫ�ط���)��
������Dԭ�ӵ��������Ϊ_________��������_________ԭ��(��Ԫ�ط���)��
����֪����ͭ�Ķѻ���ʽ�������������ܶѻ���������ͭԭ�ӵ���λ����_________���þ�����Cuԭ�ӵĿռ���������_________��
���𰸡� [Ar]3d9 �� lS22s22p63s23p63d9 N>O>S sp2 ��λ�������Ӽ� N 2NA��2��6.02��1023 C22- CuSO4��Cu(NO3)2��Ϊ���Ӿ��壬SO42-������ɱ�NO3-��CuSO4�����ܽϴ��۵�ϸߡ� ��![]() ��
��![]() ��
��![]() �� Cu 12 74%
�� Cu 12 74%
����������1��CuSO4��Cu(NO3)2�������Ӿ���ͭ���ӣ����̬��������Ų�ʽΪ [Ar]3d9 �� lS22s22p63s23p63d9���ǽ�����Խǿ����һ������Խ����Ԫ�ص�2p������Ӵ��ڰ����״̬���ȶ���ǿ����S��O��N����Ԫ�صĵ�һ�������ɴ�С��˳��ΪN>O>S�� ��2��NO3-��Nԭ�ӵļ۲���Ӷ�����3���Ҳ����ڹ¶Ե��ӣ���ƽ�������νṹ���������ԭ�ӵ��ӻ��������Ϊsp2�ӻ���[Cu(NH3)4]NO3)2�д��ڵĻ�ѧ�����ͳ��˼��Թ��ۼ��⣬�������Ӽ���������3�������[Cu(CN)4]2-��ͭ�����ṩ�չ����NԪ���ṩ�¶Ե��ӣ��γ���λ����CN-�к�����������lmol CN-�к��еĦм�����ĿΪ2NA��2��6.02��1023��ԭ�����ͼ۵������ֱ���ȵĻ�Ϊ�ȵ����壬��CN-��Ϊ�ȵ������������C22-����4������CuSO4��Cu(NO3)2��Ϊ���Ӿ��壬SO42-������ɱ�NO3-��CuSO4�����ܽϴ���������ͭ�۵�ϸߡ���5���ٸ��ݾ����ṹ������A��B��Cԭ�ӵ�ԭ�����������֪Dԭ�ӵ��������Ϊ��![]() ��
��![]() ��
��![]() ����D������ԭ�Ӿ�λ���ڲ�������4�����������ʾ��ԭ�Ӹ�����1��8��1/8��2�����D����Cuԭ�ӡ�����֪����ͭ�Ķѻ���ʽ�������������ܶѻ���������ͭԭ�ӵ���λ����12��������ͭԭ�Ӹ�����8��1/8+6��1/2=4����ͭԭ�ӵİ뾶��r������Խ�����4r��������ı߳���
����D������ԭ�Ӿ�λ���ڲ�������4�����������ʾ��ԭ�Ӹ�����1��8��1/8��2�����D����Cuԭ�ӡ�����֪����ͭ�Ķѻ���ʽ�������������ܶѻ���������ͭԭ�ӵ���λ����12��������ͭԭ�Ӹ�����8��1/8+6��1/2=4����ͭԭ�ӵİ뾶��r������Խ�����4r��������ı߳���![]() ���������������ǣ�
���������������ǣ�![]() ��3����˸þ�����Cuԭ�ӵĿռ���������
��3����˸þ�����Cuԭ�ӵĿռ���������![]() ��
��