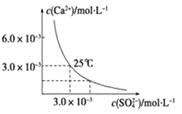
题目内容
【题目】 A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成阳离子、阴离子个数比为2:1的离子化合物丙.
(1)B的气态氢化物的电子式为_____________,请用电子式表示A与C形成化合物的过程____________。
(2)E在周期表中的位置为______________________。
(3)下列说法正确的有_________。
①化合物乙分子中只含有极性共价键
②化合物甲和化合物丙都含有离子键和共价键
③B、E分别与A形成的简单化合物中,B的更稳定
④C、D、E、F原子半径由大到小的顺序为C>D>E>F
(4)写出由以上元素构成的10电子分子与18电子分子按物质的量之比1:1反应生成盐的化学方程式_____。
【答案】(1)![]() ;
;![]() ;
;
(2)第三周期第VA族;
(3)①③④;(4)NH3+H2S=NH4HS。
【解析】试题分析:A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大,A是原子半径最小的元素,则A是H元素;B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲,则B是N元素,甲的NH4NO3;A与D可以按照原子个数比4:1形成化合物乙,则D是Si元素,乙是SiH4,且乙分子中含有18个电子,E与B同主族,则E是P元素;C的阳离子与F的阴离子相差一个电子层,且可形成阳离子、阴离子个数比为2:1的离子化合物丙,则C是Na元素,F是S元素,丙是Na2S。(1)B的气态氢化物的电子式为![]() ;H与Na通过离子键结合形成离子化合物NaH,其电子式表示的形成过程是:
;H与Na通过离子键结合形成离子化合物NaH,其电子式表示的形成过程是:![]() ;(2)E是P元素,在周期表中的位置为第三周期第VA族;(3)①化合物乙是SiH4,分子中只含有极性共价键Si—H键,正确;②化合物甲是NH4NO3,含有离子键和共价键;化合物丙是Na2S。只含有离子键,错误;③B、E的非金属性B>E,所以二者分别与A形成的简单化合物中,B的更稳定,正确;④C、D、E、F他同一周期的元素,由于原子序数越大,原子半径越小,所以原子半径由大到小的顺序为C>D>E>F,正确;(4)由以上元素构成的10电子分子NH3与18电子分子H2S按物质的量之比1:1反应生成盐的化学方程式是NH3+H2S=NH4HS。
;(2)E是P元素,在周期表中的位置为第三周期第VA族;(3)①化合物乙是SiH4,分子中只含有极性共价键Si—H键,正确;②化合物甲是NH4NO3,含有离子键和共价键;化合物丙是Na2S。只含有离子键,错误;③B、E的非金属性B>E,所以二者分别与A形成的简单化合物中,B的更稳定,正确;④C、D、E、F他同一周期的元素,由于原子序数越大,原子半径越小,所以原子半径由大到小的顺序为C>D>E>F,正确;(4)由以上元素构成的10电子分子NH3与18电子分子H2S按物质的量之比1:1反应生成盐的化学方程式是NH3+H2S=NH4HS。