题目内容
13.下列解释事实的方程式不正确的是( )| A. | 测0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 用NaCl溶液做铁的吸氧腐蚀实验,O2减少:2H2O+O2+4e-=4OH- | |
| C. | 用H2、O2进行氢氧燃料电池实验,产生电流:2H2+O2$\stackrel{点燃}{→}$2H2O | |
| D. | 用NH4Cl溶液溶解Mg(OH)2,沉淀溶解:Mg(OH)2+2NH4++2NH3•H2O |
分析 A、一水合氨为弱碱,不能完全电离;
B、当电解质溶液呈中性或弱酸性时,钢铁发生吸氧腐蚀;
C、燃料电池的条件不是点燃;
D、氯化铵中的铵根离子可以结合氢氧化镁溶解出的氢氧根,导致氢氧化镁溶解平衡右移.
解答 解:A、一水合氨为弱碱,不能完全电离,电离方程式为NH3•H2O?NH4++OH-,故0.1mol/L的氨水的pH小于13,故A正确;
B、当电解质溶液呈中性或弱酸性时,钢铁发生吸氧腐蚀,氧气在正极上放电,电极方程式为2H2O+O2+4e-=4OH-,故B正确;
C、氢氧燃料电池中氢气在负极放电,氧气在正极放电,故燃料电池的条件不是点燃,总反应为2H2+O2=2H2O,故C错误;
D、向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,氢氧化镁与铵根离子反应生成一水合氨和镁离子,反应的离子方程式为Mg(OH)2+2NH4+=2NH3•H2O+Mg2+,故D正确;
故选C.
点评 本题考查了离子方程式和电极方程式的书写判断以及原理的解释,题目难度中等,注意掌握离子方程式的书写原则,明确判断离子方程式正误常用方法.

练习册系列答案
相关题目
3.下列有关叙述正确的是( )
| A. | 60gSiO2含有SiO2分子数NA 个 | |
| B. | 仅含有共价键的化合物一定是共价化合物 | |
| C. | 尼龙绳、羊绒衫是合成高分子纤维,宣纸、棉衬衣是天然高分子纤维 | |
| D. | SiO2既可以和NaOH溶液反应,又可以与氢氟酸反应,所以其为两性氧化物 |
4.下列物质中,属于烃的是( )
| A. | CO2 | B. | CH3COOH | C. | Na2CO3 | D. | CH4 |
20.下列说法中,正确的是( )
| A. | 铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝 | |
| B. | 向氢氧化铁胶体中加入少量稀硫酸,因发生化学反应而产生红褐色沉淀 | |
| C. | 置换反应不一定都是氧化还原反应 | |
| D. | 标况下,NA个SO2分子和NA个SO3分子体积相同(NA表示阿伏加德罗常数值) |
1.钙和钠相似,也能形成过氧化物,则下列叙述正确的是( )
| A. | 过氧化钙的化学式是Ca2O2 | |
| B. | 1mol过氧化钠或过氧化钙跟足量水反应都生成0.5mol氧气 | |
| C. | 过氧化钙中钙元素的化合价为+4 | |
| D. | 过氧化钙中属于碱性氧化物 |
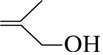 的分子式为C2H8O.
的分子式为C2H8O. 中官能团的名称羟基、羧基.
中官能团的名称羟基、羧基. .
. )为苯的同分异构体,M的二氯代物的同分异构体有3种.
)为苯的同分异构体,M的二氯代物的同分异构体有3种. )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由 (写结构简式)发生加聚反应生成的.
(写结构简式)发生加聚反应生成的. )与新制的氢氧化铜悬浊液共热的化学方程式:
)与新制的氢氧化铜悬浊液共热的化学方程式: .
. 肉桂醛是重要的医药原料,也是重要的香料,其结构简式如图所示.
肉桂醛是重要的医药原料,也是重要的香料,其结构简式如图所示. +2Cu(OH)2$\stackrel{△}{→}$Cu2O↓+2H2O+
+2Cu(OH)2$\stackrel{△}{→}$Cu2O↓+2H2O+ .
.

 .设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量稀硫酸,未见气泡产生,说明甲醛中的碳元素未被氧化成+4价.
.设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量稀硫酸,未见气泡产生,说明甲醛中的碳元素未被氧化成+4价.
