题目内容
以下是一些物质的熔沸点数据(常压):
金属钠和CO2在常压、890℃发生如下反应:
4 Na(g)+ 3CO2(g) 2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1680℃,若反应时间为10min, 金属钠的物质的量减少了0.20mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由是 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(l)的热化学方程式 。
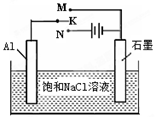
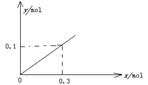
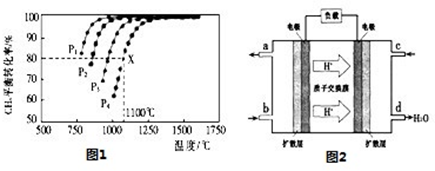
(5)下图开关K接M时,石墨作 极,电极反应式为 。K接N一段时间后测得有0.3mol电子转移,作出y随x变化的图象〖x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据〗
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:
4 Na(g)+ 3CO2(g)
 2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1680℃,若反应时间为10min, 金属钠的物质的量减少了0.20mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由是 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(l)的热化学方程式 。
(5)下图开关K接M时,石墨作 极,电极反应式为 。K接N一段时间后测得有0.3mol电子转移,作出y随x变化的图象〖x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据〗


(16分)
(1) K=1/c4(Na) c3(CO2)(2分)(指数错误或出现固体或液体表示浓度的0分,浓度c大小写不扣分);
否(2分)
(2)0.0015 mol/(L ·min)或0.0005 mol/(L ·min)或0.0015 mol/(L ·min)—0.0005 mol/(L ·min)间任意数值即可得满分(2分);单位错误或没写扣1分。
(3)增大压强,平衡向正反应方向(体积缩小的方向,生成金刚石的方向)移动(2分);(写“反应”移动不扣分)。
(4)6Na2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(l) △H=—8.4kJ/mol或3Na2O(s)+ C(s,金刚石)=4Na(g)+Na2CO3(l) △H=—4.2kJ/mol(2分)(方程式错误0分;状态和焓变单位错1或全错都只扣1分;系数减半满分;与系数匹配的焓变数值有误扣1分。)
(5)正(2分);O2+2H2O+4e- =4OH-(2分)(电极反应式错或未配平0分);
 (2分)
(2分)
(线段不出头不扣分;未标数值或标注错误扣1分,直线画为曲线0分)
(1) K=1/c4(Na) c3(CO2)(2分)(指数错误或出现固体或液体表示浓度的0分,浓度c大小写不扣分);
否(2分)
(2)0.0015 mol/(L ·min)或0.0005 mol/(L ·min)或0.0015 mol/(L ·min)—0.0005 mol/(L ·min)间任意数值即可得满分(2分);单位错误或没写扣1分。
(3)增大压强,平衡向正反应方向(体积缩小的方向,生成金刚石的方向)移动(2分);(写“反应”移动不扣分)。
(4)6Na2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(l) △H=—8.4kJ/mol或3Na2O(s)+ C(s,金刚石)=4Na(g)+Na2CO3(l) △H=—4.2kJ/mol(2分)(方程式错误0分;状态和焓变单位错1或全错都只扣1分;系数减半满分;与系数匹配的焓变数值有误扣1分。)
(5)正(2分);O2+2H2O+4e- =4OH-(2分)(电极反应式错或未配平0分);
 (2分)
(2分)(线段不出头不扣分;未标数值或标注错误扣1分,直线画为曲线0分)
试题分析:(1)固体、纯液体的浓度是常数,因此不能写入平衡常数表达式,则K=
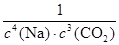 ;不同物质表示的正反应速率和逆反应之比等于化学方程式中对应的系数之比,说明该反应已经达到平衡,即
;不同物质表示的正反应速率和逆反应之比等于化学方程式中对应的系数之比,说明该反应已经达到平衡,即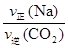 =
=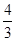 ,所以3v正(Na)=4v逆(CO2)才能说明该反应达到平衡,而4v正(Na)=3v逆(CO2)不能说明反应达到平衡;(2)碳酸钠的分解温度为1850℃,则1680℃时容器中仍发生的反应为4 Na(g)+3CO2(g)
,所以3v正(Na)=4v逆(CO2)才能说明该反应达到平衡,而4v正(Na)=3v逆(CO2)不能说明反应达到平衡;(2)碳酸钠的分解温度为1850℃,则1680℃时容器中仍发生的反应为4 Na(g)+3CO2(g) 2 Na2CO3(l)+ C(s,金刚石),先根据定义式求v(Na),再根据速率之比等于化学方程式中的系数之比求v(CO2),即v(Na)=
2 Na2CO3(l)+ C(s,金刚石),先根据定义式求v(Na),再根据速率之比等于化学方程式中的系数之比求v(CO2),即v(Na)=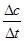 =
=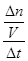 =
=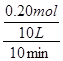 =0.0020mol/(L?min),由于
=0.0020mol/(L?min),由于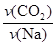 =
=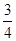 ,v(CO2)="3" v(Na)/4=0.0015mol/(L?min),注意保留两位有效数字;(3)4 Na(g)+3CO2(g)
,v(CO2)="3" v(Na)/4=0.0015mol/(L?min),注意保留两位有效数字;(3)4 Na(g)+3CO2(g) 2 Na2CO3(l)+ C(s,金刚石)的正反应是气体体积减小的方向,增大压强增大两反应物浓度时,不仅反应速率加快,而且平衡向正反应方向移动,使金刚石的制备不仅速率快而且产量多;(4)将已知两个热化学方程式编号为①②,①—②×3可以约去3 CO2(g),根据盖斯定律,则6Na2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(l) △H=—8.4kJ/mol,若系数减半,则焓变也减半,则3Na2O(s)+ C(s,金刚石)=4Na(g)+Na2CO3(l) △H=—4.2kJ/mol;(5)若K接M,则该装置为原电池,模拟铝的吸氧腐蚀,由于铝比石墨活泼,则铝是负极,石墨是正极,负极反应式为Al—3e—=Al3+,正极反应式为O2+4e—+2H2O=4OH—;若K接N,该装置变为电解池,则铝是阳极,石墨是阴极,溶液中的氢离子和钠离子移向阴极,阴极反应式为2H++2e—=H2↑或2H2O+2e—=H2↑+2OH—,阳极反应式为Al—3e—=Al3+,则电解总反应式为2Al+6H2O
2 Na2CO3(l)+ C(s,金刚石)的正反应是气体体积减小的方向,增大压强增大两反应物浓度时,不仅反应速率加快,而且平衡向正反应方向移动,使金刚石的制备不仅速率快而且产量多;(4)将已知两个热化学方程式编号为①②,①—②×3可以约去3 CO2(g),根据盖斯定律,则6Na2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(l) △H=—8.4kJ/mol,若系数减半,则焓变也减半,则3Na2O(s)+ C(s,金刚石)=4Na(g)+Na2CO3(l) △H=—4.2kJ/mol;(5)若K接M,则该装置为原电池,模拟铝的吸氧腐蚀,由于铝比石墨活泼,则铝是负极,石墨是正极,负极反应式为Al—3e—=Al3+,正极反应式为O2+4e—+2H2O=4OH—;若K接N,该装置变为电解池,则铝是阳极,石墨是阴极,溶液中的氢离子和钠离子移向阴极,阴极反应式为2H++2e—=H2↑或2H2O+2e—=H2↑+2OH—,阳极反应式为Al—3e—=Al3+,则电解总反应式为2Al+6H2O 2Al(OH)3+3H2↑~6e—,若转移0.3mol电子,则被消耗的水为0.3mol;由于该反应中氢氧化铝与水的系数之比等于物质的量之比,则
2Al(OH)3+3H2↑~6e—,若转移0.3mol电子,则被消耗的水为0.3mol;由于该反应中氢氧化铝与水的系数之比等于物质的量之比,则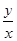 =
=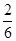 ,即y=x/3;然后在坐标纸上用描点法画图,若x=0,则y=0;x=0.3,则y=0.1,将两点连线即可画图。
,即y=x/3;然后在坐标纸上用描点法画图,若x=0,则y=0;x=0.3,则y=0.1,将两点连线即可画图。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
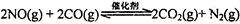 。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断: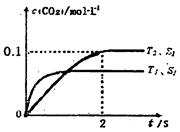
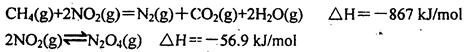
 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
 2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):

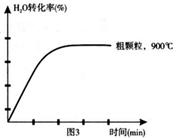
 Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)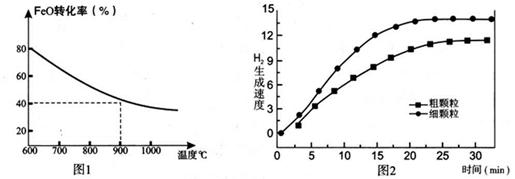

 2NH3(g) ΔH=-92.4 kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g) ΔH=-92.4 kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
 2NO(g) ΔH=+180.5 kJ·mol-1
2NO(g) ΔH=+180.5 kJ·mol-1